Problematiek "medicijntekort" roept Kamervragen op
 Naar aanleiding van het bericht "Medicijntekort was nog nooit zo groot"(Volkskrant van 12 oktober 2012) zijn Kamervragen gesteld aan minister Schippers. Het medicijntekort volgt cijfers van databank Farmanco, een databank waar apothekers medicijntekorten registreren. Een registratie in 2010 geeft 174 onverkrijgbare medicijnen aan tegen 242 onverkrijgbare medicijnen in 2011. Schippers geeft aan een project te zijn gestart ‘Borging continuïteit geneesmiddelenvoorziening’. In dit project wordt samen met de Inspectie voor de Gezondheidszorg (IGZ), het College ter Beoordeling van Geneesmiddelen (CBG) en het Rijks Instituut voor Volksgezondheid en Milieu (RIVM) bekeken wat mogelijke oorzaken van tekorten zijn en welke oplossingen kunnen worden ingezet. Een paar vragen zijn hieronder gezet :
Naar aanleiding van het bericht "Medicijntekort was nog nooit zo groot"(Volkskrant van 12 oktober 2012) zijn Kamervragen gesteld aan minister Schippers. Het medicijntekort volgt cijfers van databank Farmanco, een databank waar apothekers medicijntekorten registreren. Een registratie in 2010 geeft 174 onverkrijgbare medicijnen aan tegen 242 onverkrijgbare medicijnen in 2011. Schippers geeft aan een project te zijn gestart ‘Borging continuïteit geneesmiddelenvoorziening’. In dit project wordt samen met de Inspectie voor de Gezondheidszorg (IGZ), het College ter Beoordeling van Geneesmiddelen (CBG) en het Rijks Instituut voor Volksgezondheid en Milieu (RIVM) bekeken wat mogelijke oorzaken van tekorten zijn en welke oplossingen kunnen worden ingezet. Een paar vragen zijn hieronder gezet :
Vraag 3
Wat is volgens u de oorzaak van het medicijntekort? Is dit een gevolg van de crisis of ligt het aan het preferentiebeleid?
Antwoord: Oorzaken/risicofactoren van (tijdelijke) geneesmiddelentekorten kunnen van velerlei aard zijn. In de bijlage van mijn brief van 10 januari 2012 (TK 2011 –2012, 29 47, nr.181) treft u een overzicht aan van denkbare factoren1 die kunnen leiden tot (tijdelijke) geneesmiddeltekorten. Voor zover nu bekend kunnen tekorten inderdaad ontstaan als gevolg van onder andere het preferentiebeleid. Bij het preferentiebeleid gaat het echter om tekorten van als preferent aangewezen geneesmiddelen. Dat wil zeggen dat er wel geneesmiddelen beschikbaar zijn met dezelfde werkzame stof als de tijdelijk niet voorradige preferente variant. De zorgverzekeraar heeft een zorgplicht en is daarmee de verantwoordelijke partij die voor een oplossing moet zorgen.Vraag 5
Verwacht u een stijging van medicijntekorten in de toekomst? Zo nee, waarom niet? Zo ja, welke maatregelen gaat u hiertegen nemen?
Antwoord: In hoeverre in de toekomst vaker leveringsproblemen zullen optreden kan ik op dit moment niet voorzien. De volgend jaar te implementeren Europese richtlijn vervalsingen zou wellicht tot tekorten kunnen leiden. Die richtlijn stelt eisen aan de import van actieve werkzame stoffen (API’s) om vervalsingen tegen te gaan. Dit kan er mogelijk toe leiden dat de Europese markt voor fabrikanten uit bijvoorbeeld China en India minder interessant kan worden om te beleveren met mogelijke tekorten als gevolg. Gezocht moet worden naar een stelsel van regelingen en afspraken die recht doen aan beide aspecten: het belang van het tegengaan van vervalsingen en het belang van het toegankelijk houden van de markt van geneesmiddelen om tekorten te voorkomen. Mijn streven is er in ieder geval op gericht om waarborgen tot stand te brengen tegen risicovolle leveringsproblemen. Om die reden heb ik het hiervoor genoemde project “Borging Continuïteit Geneesmiddelenvoorziening” in het leven geroepen. Ook zal ik in de EU mijn zorgen uiten ten aanzien van de import van API's uit India en China waardoor mogelijk geneesmiddelentekorten kunnen ontstaan.
 De Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie (KNMP) heeft het adviesbureau Booz & Company opdracht gegeven voor het maken van dit rapport dat apotheker zorgkosten kunnen drukken. Dit rapport is (nog) niet openbaar beschikbaar. Hierover worden vragen gesteld door lid Bruins Slot aan minister Schippers (VWS). Een paar vragen zijn hieronder gezet :
De Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie (KNMP) heeft het adviesbureau Booz & Company opdracht gegeven voor het maken van dit rapport dat apotheker zorgkosten kunnen drukken. Dit rapport is (nog) niet openbaar beschikbaar. Hierover worden vragen gesteld door lid Bruins Slot aan minister Schippers (VWS). Een paar vragen zijn hieronder gezet : Minister Schippers kondigt per Kamerbief de ministeriële regeling aan met betrekking tot het voorschrijven van Uitsluitend Recept-geneesmiddelen (hierna: UR-geneesmiddelen) door bepaalde categorieeen van verpleegkundigen. De UR-geneesmiddelen die door bepaalde categorieën deskundigen voorgeschreven mogen worden hebben betrekking op de gebieden van astma en COPD, diabetes mellitus en oncologie. De voorlegging van de ministeriële regeling geschiedt ter uitvoering van de voorhangprocedure in
Minister Schippers kondigt per Kamerbief de ministeriële regeling aan met betrekking tot het voorschrijven van Uitsluitend Recept-geneesmiddelen (hierna: UR-geneesmiddelen) door bepaalde categorieeen van verpleegkundigen. De UR-geneesmiddelen die door bepaalde categorieën deskundigen voorgeschreven mogen worden hebben betrekking op de gebieden van astma en COPD, diabetes mellitus en oncologie. De voorlegging van de ministeriële regeling geschiedt ter uitvoering van de voorhangprocedure in  Het College ter Beoordeling van Geneesmiddelen (CBG) organiseert op 6 november 2012 een hoorzitting naar aanleiding van het bezwaar dat de vennootschap Cosmo Technologies Ltd heeft aangetekend tegen het besluit van het College d.d. 13 september 2012 tot weigering van de volgende handelsvergunning: RVG 110023 Cortiment MMX (9 mg budesonide maagsapresistente tablet).
Het College ter Beoordeling van Geneesmiddelen (CBG) organiseert op 6 november 2012 een hoorzitting naar aanleiding van het bezwaar dat de vennootschap Cosmo Technologies Ltd heeft aangetekend tegen het besluit van het College d.d. 13 september 2012 tot weigering van de volgende handelsvergunning: RVG 110023 Cortiment MMX (9 mg budesonide maagsapresistente tablet). Beleidsregel vergoeding dure medicijnen (Vectibix). NZa heeft in redelijkheid kunnen komen tot een vaste correctiefactor voor vier jaar. Uit gegevens over één patiënt kan geen gemiddelde worden afgeleid.
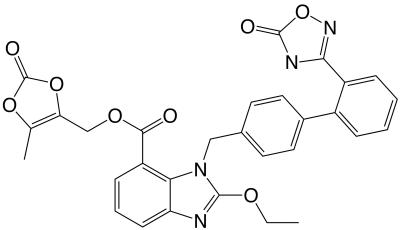
Beleidsregel vergoeding dure medicijnen (Vectibix). NZa heeft in redelijkheid kunnen komen tot een vaste correctiefactor voor vier jaar. Uit gegevens over één patiënt kan geen gemiddelde worden afgeleid..gif) Octrooirecht. ABC. Eén van kracht zijnd basisoctrooi dat meerdere producten beschermt, en dat aan de houder van het basisoctrooi een certificaat wordt afgegeven voor ieder van de beschermde producten. Na de heropening
Octrooirecht. ABC. Eén van kracht zijnd basisoctrooi dat meerdere producten beschermt, en dat aan de houder van het basisoctrooi een certificaat wordt afgegeven voor ieder van de beschermde producten. Na de heropening 
 Een bijdrage van Corina Wolfert,
Een bijdrage van Corina Wolfert,  Een samenvatting van de brief met de volgende onderwerpen:
Een samenvatting van de brief met de volgende onderwerpen:















