HvJ EU: EU-recht verzet zich tegen regeling die gehalte nutriënten die dagelijkse maximumdoses overschrijd verbiedt

HvJ EU 27 april 2017, C-672/15; ECLI:EU:C:2017:310 (Noria) Onderlinge aanpassing van de wetgevingen der lidstaten inzake voedingssupplementen – Vitaminen en mineralen die voor de vervaardiging van voedingssupplementen mogen worden gebruikt – Maximumhoeveelheden – Bevoegdheid van de lidstaten – Nationale regeling waarbij die hoeveelheden worden vastgesteld – Wederzijdse erkenning – Geen – Voorwaarden en criteria die in acht moeten worden genomen bij de vaststelling van die hoeveelheden.
1) De bepalingen van [richtlijn voedingssupplementen], en die van het Verdrag betreffende de werking van de Europese Unie inzake het vrij verkeer van goederen moeten aldus worden uitgelegd dat zij zich verzetten tegen een regeling van een lidstaat als die in de hoofdzaak, die niet voorziet in een procedure voor het in die lidstaat op de markt brengen van voedingssupplementen waarvan het gehalte nutriënten de bij die regeling vastgestelde dagelijkse maximumdoses overschrijdt en die in een andere lidstaat rechtmatig zijn vervaardigd of in de handel gebracht.
Directe inbreuk op tweede medische indicatie voor osteoporose

Rechtbank Den Haag 5 april 2017, IEF 16729; LS&R 1445; ECLI:NL:RBDHA:2017:3430 (Sun Pharmaceutical tegen Novartis) Octrooirecht. Eindvonnis. Tweede medische indicatie. Vgl. HR-uitspraak 14 april, IEF 16723. Swiss type claim. Sun laat haar zoledroninezuur bereiden door Sun, gevestigd in India (hierna: Sun India). Verhandeling in Nederland van rechtstreeks verkregen product van in buitenland toegepaste werkwijze door gelieerde concernonderneming is een directe inbreuk op EP 689 B3. Sun dient de schade te vergoeden en alle verzekeringsmaatschappijen die een tender hebben uitgeschreven waaraan Sun heeft meegedaan en alle partijen waarmee Sun een overeenkomst heeft, te informeren. Sun kan uitsluitend deelnemen in een tenderprocedure/leveren volgens een overeenkomst die voldoende garandeert dat de levering van 5mg/100ml zoledroninezuur voor de behandeling van osteoporose wordt voorkomen.
Uitspraak mede ingezonden door Thijs van Aerde, Houthoff Buruma; Rutger Kleemans en Jelle Drok, Freshfields Bruckhaus Deringer.
HR: Sun heeft het niet in haar macht indirecte octrooiinbreuken in de distributieketen volledig te verhinderen

HR 14 april 2017, IEF 16723; LS&R 1444; ECLI:NL:HR:2017:692 (Sun Pharmaceutical tegen Novartis) Octrooirecht. Kort geding-cassatie na IEF 14599 en IEF 13841. Octrooi voor tweede medische indicatie. Swiss-type claim. Het beroep op een prioriteitsdocument dient te worden onderzocht of in dat document, in zijn geheel beschouwd, de geclaimde uitvinding direct en ondubbelzinnig aan de gemiddelde vakman, die gebruik maakt van zijn algemene vakkennis, wordt geopenbaard. Het hof heeft die juiste maatstaf vooropgesteld.
Het hof heeft terecht geoordeeld dat – ervan uitgaande dat indirecte inbreuk op een ‘Swiss-made claim’ rechtens mogelijk is – onder die omstandigheden aan de vereisten van indirecte octrooi-inbreuk als bedoeld in art. 73 lid 1 ROW 1995 is voldaan. Indirecte inbreuk. Van producent zijn er te verlangen inspanningen om te voorkomen dat zijn product voor de geoctrooieerde indicatie wordt voorgeschreven. Het is niet in de macht van Sun om inbreuk in de distributieketen en bij het gebruik van haar product steeds en volledig te verhinderen.
Geen strijd met het mededingingsrecht (r.o. 3.6.3 en .4). Verbod is te algemeen, waardoor executieproblemen mogelijk zijn. In kort-gedingcassatie behoeft geen afstemming met oordeel bodemrechter aan de orde [IEF 16729]. Het verwijzingshof dient zich wel ernaar te richten. Beroep wordt verworpen.
Uitspraak ingezonden door Marloes Meddens-Bakker, The Law Factor.
Ontbreken verwijzing naar JAK-remmers of naderend geneesmiddel

CGR 12 april 2017, LS&R 1443; RB 2838 (Eli Lilly tegen Pfizer) Geen reclame. Beide partijen wachten de verlening van een EU-handelsvergunning af voor een nieuw geneesmiddel voor de behandeling van reumatoïde artritis. Lilly voor haar Olumiant, Pfizer voor Xeljanz, het zijn janus kinase (JAK)ontstekingsremmers.
Pfizer heeft de aandacht van Nederlandse beroepsbeoefenaren gevestigd op de rol die JAK spelen bij het ontstaan van ontstekingen. Deze uitingen kunnen volgens Lilly niet kwalificeren als zuivere informatie ex 5.1.2 en 5.1.3 van de Gedragscode en stelt dat er sprake is van een verkapte vorm van reclame voor haar nog niet geregistreerde JAK-remmer Xeljanz. Alhoewel de Commissie inziet dat er een commercieel belang is om vooruitlopend op de naderende introductie van haar geneesmiddel bij beroepsbeoefenaar de aandacht te vestigen op de rol van JAK pathways, acht de Codecommissie vanwege ontbreken van verwijzingen naar tofacitinib of Xejanz of JAK-remmers in het algemeen het verband tussen de uiting te verwijderd om aan de uitingen een aanprijzend karakter toe te kennen. Ook uitingen die voor publiek toegankelijk waren, zijn geen publieksreclame.
Mailing 'samen met de Maag Lever Darm stichting' met logo Thiosix is overtreding Code Publieksreclame Geneesmiddel

CGR 9 maart 2017, LS&R 1442; RB 2837, K17.002 (CGR/Teva) - ingetrokken De CGR heeft een melding ontvangen over een mogelijke overtreding van de regels inzake geneesmiddelenreclame door Teva Nederland. De melding ziet op een mailing/insert bij VOZ Magazine december 2016 – ‘Samen met de Maag Lever Darm Stichting de toekomst in’ waarop het logo van Thiosix® is vermeld. Serieus signaal over reclame voor receptgeneesmiddel richting publiek. Beklaagde berust in oordeel – klacht afgedaan met publicatie van de feiten en betaling kosten secretariaat.
Ziekenhuis aansprakelijk voorschrijven van Prednison zonder botversterkende middelen
Rechtbank Midden-Nederland 19 oktober 2016, LS&R ; ECLI:NL:RBMNE:2016:7641 (verzoeker tegen Stichting Alrijne Zorggroep, Medirisk) [verzoeker] , geboren op [1945] , lijdt aan Chronic Obstructive Pulmonary Disease (COPD), een chronische longziekte. [verzoeker] is vanaf 1993 bekend met COPD. Zij heeft fracturen in rugwervels opgelopen en stelt het ziekenhuis aansprakelijk gesteld voor het onzorgvuldig behandelen van COPD, meer in het bijzonder voor het voorschrijven van Prednison en zonder daarnaast botversterkende middelen. De rechtbank verklaart voor recht dat er causaal verband (6:98 BW) is tussen de gemaakte medische fouten ex artikel 6:162 BW van het ziekenhuis en de artsen en de bij verzoeker ontwikkelde rugfracturen.
4.28.
De rechtbank overweegt het volgende. [verzoeker] heeft het verzoek tot het tweede deelgeschil ingesteld omdat tussen partijen een discussie is ontstaan bij de uitvoering van de medische expertise door [B] . Zij zijn in de gelegenheid gesteld om nadere vragen te stellen, maar niet tot overeenstemming konden komen over de (nader) te stellen vragen, meer in het bijzonder over de vraag of de door [verzoeker] voorgestelde vragen wel passend waren gelet op de oorspronkelijke vraagstelling. Met name de vraag of de Prednisonmedicatie gedurende de periode 2007 – 2009 door [B] in zijn onderzoek moest worden betrokken vormde de aanleiding voor de discussie tussen partijen. Uiteindelijk is het rapport van [B] , zonder deze gegevens, tot uitgangspunt genomen voor de beoordeling van de causaliteit. Dit neemt naar het oordeel van de rechtbank niet weg dat kan worden aangenomen dat er voor [verzoeker] voldoende aanleiding was om de vraag te willen voorleggen. [verzoeker] had immers door de royale afgifte van Prednison, zonder gebruik van botschermende medicatie, letsel opgelopen, en mocht er in redelijkheid van uitgaan dat de aanvullende gegevens over de duur en omvang van de Prednisonmedicatie mogelijk van belang zouden zijn. Geoordeeld wordt dat Alrijne ten onrechte heeft geweigerd haar instemming te verlenen met de vraagstelling van [verzoeker] op dit onderdeel, zodat het in overwegende mate aan Alrijne is te wijten dat de onderhandelingen zijn vastgelopen. Dit betekent dat de kosten die [verzoeker] heeft gemaakt om de onderhandelingen vlot te trekken, en om te trachten om alle medische gegevens en de apothekerslijsten te verkrijgen, als redelijke kosten worden aangemerkt.
Dat [verzoeker] aanleiding heeft gezien om geen medewerking te verlenen aan de expertise totdat er duidelijk zou bestaan over de nader te stellen vragen, doet daaraan niet af. Naar het oordeel van de rechtbank dient het beroep van [verzoeker] op het blokkeringsrecht ook aldus te worden begrepen en niet als een beroep op het blokkeringsrecht.
Geen bijzondere waarschuwingsplicht bij discrepantie tussen bijsluiter van vaccin en werkinstructie
Rechtbank Midden-Nederland 15 maart 2017, LS&R 1440; ECLI:NL:RBMNE:2017:1148 (eiser tegen Bayer) Aansprakelijkheid. Inenting van runderen tegen IBR. Bayer had, als fabrikant geen bijzondere waarschuwingsplicht voor een discrepantie tussen de bijsluiter bij het vaccin en de werkinstructie van de Gezondheidsdienst voor Dieren.
2.3. Het oordeel van deze rechtbank in het tussenvonnis van 14 december 2005 kan als volgt worden samengevat. De tekst van de bijsluiter was duidelijk en niet ondeugdelijk. Er is wel een verschil tussen de bijsluiter en de werkinstructie:
Volgens de bijsluiter dienen met IBR-geïnfecteerde runderen of dieren met een groot infectierisico, ook de drachtige runderen, eerst intranasaal gevaccineerd te worden, terwijl volgens de werkinstructie de enting van het rundvee intramusculair dan wel subcutaan toegepast dient te worden en intranasale vaccinatie alleen in hoge uitzonderingsgevallen is toegestaan als noodvaccinatie bij acute klinische IBR-uitbraak.
Die discrepantie houdt mogelijk in dat wanneer de werkinstructie wordt gevolgd in afwijking van de bijsluiter de met IBR-geïnfecteerde runderen of dieren met een groot infectierisico niet in alle gevallen eerst intranasaal gevaccineerd zullen worden, doch alleen indien er sprake is van een noodgeval bij een acute klinische IBR-uitbraak.
Van het bestaan van die afwijking kan Bayer geen verwijt gemaakt worden, maar zij had op dat punt misschien wel een waarschuwingsplicht. Voor een onderzoek daarnaar heeft de rechtbank een deskundigenonderzoek bevolen. De vordering tegen een derde gedaagde is in het tussenvonnis van 14 december 2005 al afgewezen. Dit tussenvonnis is bekrachtigd door het Gerechtshof Amsterdam op 17 januari 2008.2.13. Op grond van de beantwoording van de deskundigen komt de rechtbank tot de slotsom dat:
- er geen relevante afwijking is tussen bijsluiter en werkinstructie in die zin dat te voorzien was dat naleving van de werkinstructie er in de praktijk toe zou leiden dat runderen intramusculair werden geënt die volgens de bijsluiter eerst intranasaal geënt moesten worden;
- er mogelijk wel schadelijke gevolgen verbonden waren aan het intramusculair enten van dieren die eerst nasaal geënt moesten worden, maar
- dat die mogelijke gevolgen voor de autoriteiten belast met de entcampagne en voor de dierenartsen bekend waren.
Onder deze omstandigheden ziet de rechtbank geen reden een bijzondere waarschuwingsplicht voor Bayer aan te nemen. De vordering van [eisers] zal worden afgewezen.
Robbert Sjoerdsma, Holla Advocaten.
De beroepsbeoefenaar zal het woord 'afgegeven' niet opvatten als dat de dosis de longen heeft bereikt

CGR 15 maart 2017, RB 2831; LS&R 1439; K16-008 (Boehringer-Ingelheim tegen Teva Nederland) Samenvatting: De klacht van Boehringer Ingelheim heeft betrekking op een advertentie van Teva voor haar geneesmiddel Tiotrus® Zonda®. De klacht van Boehringer Ingelheim is gericht tegen de claims “Doorzichtige capsule – bevestiging dat dosis is afgegeven” en “Nieuwe inhalator met doorzichtige capsules, waardoor u zeker weet dat de dosis is afgegeven”. Boehringer Ingelheim stelt zich – kort weergegeven – op het standpunt dat de uiting gebruik in strijd met de SmPC en bijsluiter in de hand werkt en dat de uiting misleidend en verwarrend is en het rationeel gebruik niet bevordert. Teva betwist de klacht en voert gemotiveerd verweer.
De Codecommissie is - anders dan Boehringer Ingelheim - van oordeel dat voornoemde claims in combinatie met de afbeelding van een doorzichtige capsule niet de suggestie wekken dat alle werkzame stof de capsule heeft verlaten en beroepsbeoefenaren daardoor op het verkeerde been zouden worden gezet. Van misleiding is naar het oordeel van de Codecommissie op dit punt geen sprake.
Ook zal de beroepsbeoefenaar naar het oordeel van de Codecommissie het woord “afgegeven” in de claims “Doorzichtige capsule – bevestiging dat dosis is afgegeven” en “Nieuwe inhalator met doorzichtige capsules, waardoor u zeker weet dat de dosis is afgegeven” niet opvatten in de zin dat de afgeleverde dosis werkzame stof de longen heeft bereikt, maar dat de afgeleverde dosis werkzame stof het mondstuk van de inhalator heeft verlaten. Van misleiding is naar het oordeel van de Codecommissie op dit punt eveneens geen sprake.
Afwijzing van opname in de REACH-lijst van zeer zorgwekkende stoffen
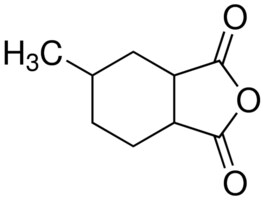
HvJ EU 15 maart 2017, LS&R 1436; ECLI:EU:C:2017:208; C-324/15P (Hitachi) Verordening (EG) nr. 1907/2006 (REACH‑verordening) – Artikel 57, onder f) – Autorisatie – Zeer zorgwekkende stoffen – Identificatie – Even zorgwekkende stoffen – Hexahydromethylftaalzuuranhydride, hexahydro-4-methylftaalzuuranhydride, hexahydro-1-methylftaalzuuranhydride en hexahydro-3-methylftaalzuuranhydride. Met hun hogere voorziening verzoeken Hitachi en Polynt om vernietiging van het arrest van het Gerecht (T‑135/13, EU:T:2015:253), houdende verwerping van hun beroep tot gedeeltelijke nietigverklaring van besluit ED/169/2012 van het ECHA over de opname van zeer zorgwekkende stoffen in de lijst van kandidaatstoffen REACH. De hogere voorziening wordt afgewezen.

















