Geen gevaar voor mensen met normaal cholesterolgehalte
RCC 16 oktober 2012 dossiernr. 2012/00662 (klager tegen Becel pro. activ)
 Op de verpakking staat dat Becel pro.activ actief cholesterol verlaagt en - op de onderzijde van de verpakking - dat het product “uitsluitend is bedoeld voor mensen die hun cholesterolgehalte willen verlagen.” Op de verpakking wordt niet meegedeeld dat het product alleen bedoeld is voor mensen met een verhoogd cholesterolgehalte.
Op de verpakking staat dat Becel pro.activ actief cholesterol verlaagt en - op de onderzijde van de verpakking - dat het product “uitsluitend is bedoeld voor mensen die hun cholesterolgehalte willen verlagen.” Op de verpakking wordt niet meegedeeld dat het product alleen bedoeld is voor mensen met een verhoogd cholesterolgehalte.
Klager acht de verpakking van Becel pro.activ misleidend is, omdat deze niet duidelijk maakt dat het product uitsluitend bedoeld is voor mensen met een (bewezen) verhoogd cholesterolgehalte. Volgens de klager ligt het voor de hand dat consumenten preventief, uit angst voor een te hoog cholesterolgehalte, Becel pro.activ gaan gebruiken.
De Commissie acht dat Unilever voldoende heeft weersproken dat er Becel pro.activ gevaar oplevert bij consumptie door mensen met een normaal cholesterolgehalte, daarnaast is de verpakking niet in strijd met de Europese regelgeving. De klacht wordt afgewezen.
De Commissie stelt voorop dat de onderhavige beslissing betrekking heeft op - en beperkt is tot - wat door klager is omschreven als “de kern van de klacht”, te weten de mededeling “Dit product is uitsluitend bedoeld voor mensen die hun cholesterolgehalte willen verlagen”, welke omschrijving ruimer is dan de specifieke groep van mensen met een (bewezen) verhoogd cholesterolgehalte.
Vast is komen te staan dat aan Unilever in 2000 vergunning is verleend voor het op de markt brengen van Becel pro.activ als “smeersel op basis van gele vetten” (beschikking 2000/500/EC). In de beschikking zijn aanvullende bijzondere etiketteringsvoorschriften gesteld, die bij Verordening (EG) 608/2004 d.d. 31 maart 2004 van toepassing zijn verklaard op onder andere alle voedingsmiddelen waaraan plantensterolen zijn toegevoegd, zoals Becel pro.activ. Op grond van artikel 2 lid 3 van deze verordening moet in de etikettering van dergelijke voedingsmiddelen worden vermeld: “dat het product uitsluitend bedoeld is voor mensen die hun bloedcholesterolgehalte willen verlagen”. Deze doelgroepomschrijving is op de verpakking van Becel pro.activ nagenoeg identiek en goed leesbaar overgenomen, zodat de verpakking op dit punt in overeenstemming is met de van toepassing zijnde Europese regelgeving.
De Commissie acht de formulering van de doelgroep op de verpakking ook niet misleidend. Unilever heeft voldoende gemotiveerd weersproken dat door het ontbreken van de vermelding dat Becel pro.activ uitsluitend voor mensen met een (bewezen) verhoogd cholesterolgehalte bedoeld is, gevaar voor de veiligheid ontstaat bij consumptie door mensen met een ‘normaal’ cholesterolgehalte. De Commissie acht ook voldoende toegelicht dat de status van dieetproduct in Duitsland en Oostenrijk heeft geleid tot een op nationale regelgeving voor dieetproducten gebaseerde afwijkende beschrijving van de doelgroep van Becel pro.activ, die echter niet van toepassing is op de verpakking(stekst) van in Nederland op de markt gebrachte Becel pro.activ.
 In de bestreden uiting wordt gesteld dat colloïdaal zilver “het Eérste Redmiddel bij Virussen, Bacteriën, Schimmels, Parasieten en Prionen” is. Klaagster legt een monografie van de Natural Medicines Comprehensive Database betreffende colloïdaal zilver over. Uit de onder “Effectiveness” weergegeven conclusie blijkt dat er geen bewijs is voor de werkzaamheid van colloïdaal zilver, ook in de medische literatuur is niets hierover te vinden.
In de bestreden uiting wordt gesteld dat colloïdaal zilver “het Eérste Redmiddel bij Virussen, Bacteriën, Schimmels, Parasieten en Prionen” is. Klaagster legt een monografie van de Natural Medicines Comprehensive Database betreffende colloïdaal zilver over. Uit de onder “Effectiveness” weergegeven conclusie blijkt dat er geen bewijs is voor de werkzaamheid van colloïdaal zilver, ook in de medische literatuur is niets hierover te vinden.


.png) In navolging van
In navolging van 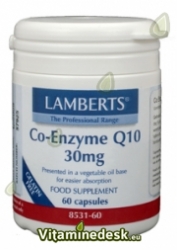 Reclamerecht. Aanprijzing Lamberts Co-enzym Q10 30mg op website. Klager vindt deze uiting in strijd met art. 2, art.4, art. 6 t/m 9 NRC nu in uiting o.a. staat: "Een gebrek aan CoQ10 wordt geassocieerd met parodontale aandoeningen." Ook acht klager uiting in strijd met reclamecode van Keuringsraad KOAG/KAG. Verweerder zegt advertentie te hebben aangepast aan de regels.
Reclamerecht. Aanprijzing Lamberts Co-enzym Q10 30mg op website. Klager vindt deze uiting in strijd met art. 2, art.4, art. 6 t/m 9 NRC nu in uiting o.a. staat: "Een gebrek aan CoQ10 wordt geassocieerd met parodontale aandoeningen." Ook acht klager uiting in strijd met reclamecode van Keuringsraad KOAG/KAG. Verweerder zegt advertentie te hebben aangepast aan de regels. Reclamerecht. Uiting betreft een aan klager geadresseerde folder over ProstEase. Klager stelt dat de zinsnede "uw prostaatproblemen" misleidend is. Ook bezwaar tegen dit product als herstelmiddel. Verweerder stelt dat ProsEase als natuurlijk voedingssuplement wordt aangeprezen en niet als vervanging voor medisch advies of medicatie.
Reclamerecht. Uiting betreft een aan klager geadresseerde folder over ProstEase. Klager stelt dat de zinsnede "uw prostaatproblemen" misleidend is. Ook bezwaar tegen dit product als herstelmiddel. Verweerder stelt dat ProsEase als natuurlijk voedingssuplement wordt aangeprezen en niet als vervanging voor medisch advies of medicatie. 
 Warenwet; procesbelang, principieel belang bij inhoudelijk oordeel gelegen in toekomstige handhavingsverzoeken; handhavingsverzoek niet voldoende specifiek, feitelijk gericht op wijziging controle- en handhavingsbeleid.
Warenwet; procesbelang, principieel belang bij inhoudelijk oordeel gelegen in toekomstige handhavingsverzoeken; handhavingsverzoek niet voldoende specifiek, feitelijk gericht op wijziging controle- en handhavingsbeleid.
















