Geneesmiddelenwet: verordening 2001/83
Rechtbank Breda 2 februari 2011, LJN BP5365 (Eiser tegen het College ter Beoordeling van Geneesmiddelen (CBG))Geneesmiddelenwet: art. 42 Richtlijn Europees Parlement en Raad 6 november 2001 (nr. 2001/83/EG), zoals gewijzigd op 31 maart 2004 (nr. 2004/27/EG): art. 28 en 29 Handelsvergunning geneesmiddel (levocetirizine PCH), dit wil zeggen: registratie ervan door College ter beoordeling van geneesmiddelen. Wederzijdse erkenning na gedecentraliseerde procedure. Beoordeling van geneesmiddel door referentielidstaat. Algehele instemming met andere lidstaten. In dat geval mag andere lidstaat dan referentielidstaat beoordelingsrapport van het geneesmiddel slechts afwijzen indien een gegronde reden bestaat om aan te nemen dat het betreffende middel ernstig risico voor de volksgezondheid kan opleveren. Vervolg van Vznr. Rb. Breda 20 juli 2009, proc.nr. 09 / 2200 BESLU VV (LJN: BJ3033) Verwijzing naar HvJEG 16 oktober 2008, proc.nr. C-452/06 (LJN: BG4359; Synthus-arrest)
Op 18 december 2006 heeft het moederbedrijf van X handelsvergunningen aangevraagd bij verschillende lidstaten van de EU voor het geneesmiddel 'Levocetirizine diHCL 5 PCH, filmomhulde tabletten 5 mg' (Levocetirizine PCH). Duitsland is opgetreden als referentiestaat. Bij besluit heeft het College vervolgens een handelsvergunning verleend, door registratie van Levocetirizine PCH onder nummer RVG 34946. Eiseres heeft bezwaar gemaakt tegen het primaire besluit. Zij is sinds 2001 houder van de handelsvergunning voor levocetirizine bevattende geneesmiddel Xyzal en Zyrtec, dat de werkzame stof cetirizine bevat. Eiseres is van mening dat de handelsvergunning voor Levocetirizine PCH niet verleend had mogen worden.
2.4 De rechtbank is met verweerder van oordeel dat de ruimte van verweerder om het beoordelingsrapport van het BfArM geheel of gedeeltelijk af te wijzen, is beperkt door artikel 29, eerste lid, van de Richtlijn. Alleen als er een gegronde reden is om aan te nemen dat het middel Levocetirizine PCH een ernstig risico voor de volksgezondheid kan opleveren, kan verweerder goedkeuring van het beoordelingsrapport van het BfArM weigeren.
Dit blijkt uit de opzet van de in hoofdstuk 4, titel III, van de Richtlijn vastgelegde procedure en de dwingende wijze waarop artikel 28, vierde en vijfde lid, en artikel 29, eerste lid, van de Richtlijn zijn geformuleerd. Deze uitleg stemt ook overeen met de doelstelling van de Richtlijn om de belemmeringen van het vrije verkeer van geneesmiddelen in de Europese Gemeenschap weg te nemen en nodeloze doublures van controles en onderzoeken te voorkomen. Zowel de wederzijdse erkenningsprocedure en de gedecentraliseerde procedure zijn gebaseerd op het principe van erkenning van de beoordeling die reeds is gedaan door een ander lidstaat, de referentielidstaat.
Dit betekent dat een andere lidstaat dan de referentielidstaat niet zelfstandig mag toetsen of de bridging data voldoende zijn, dan wel of de dossierbescherming van een ander geneesmiddel is geschonden. Dit betekent ook dat een lidstaat uitsluitend beoordeelt - op basis van het beoordelingsrapport van de referentielidstaat - of er ernstige risico’s kunnen zijn voor de volksgezondheid. De beoordelingsmarge van de lidstaat is dus zeer beperkt. De andere lidstaten moeten zich verlaten op de vaststellingen en de wetenschappelijke beoordeling die de referentielidstaat heeft verricht. Het een en ander wordt bevestigd in het Synthonarrest van het Hof van Justitie, welk arrest nog steeds relevant is voor de uitleg van de artikelen 28 en 29 van de Richtlijn.(...)
De rechtbank is daarom met verweerder van oordeel dat het bestreden besluit niet verder strekt dan het oordeel dat geen sprake is van een ernstig risico voor de volksgezondheid, de vaststelling dat de aanvraag volledig is en identiek is aan het dossier dat is ingediend bij het BfArM en de vaststelling dat het BfArM de procedure heeft afgesloten. Eiseres heeft hiertegen geen beroepsgronden gericht. Verweerder was dus gehouden om een handelsvergunning voor Levocetirizine PCH aan vergunninghoudster te verstrekken. Het bestreden besluit is rechtmatig.
Dit oordeel heeft tot gevolg dat de rechtbank niet toekomt aan een inhoudelijke bespreking van de klachten van eiseres over de totstandkoming en inhoud van het beoordelingsrapport van het BfArM inzake Levocetirizine PCH. Daarmee zou de rechtbank immers buiten de grenzen van het geschil treden, aangezien zij aldus de aanvraag indringender zou toetsen dan waartoe verweerder is gerechtigd. Dit zou in strijd zijn met het bepaalde in artikel 8:1, eerste lid, van de Algemene wet bestuursrecht (Awb) gelezen in verbinding met artikel 8:69, eerste lid, van de Awb.

 Uitspraak ingezonden door Marjanka Vermunt,
Uitspraak ingezonden door Marjanka Vermunt,  Wet geneesmiddelenprijzen. Regeling referentieprijslijsten geneesmiddelen (RRG). De minister heeft niet in strijd met artikel 1, aanhef en onder a, van de RRG de Tvz-lijst buiten beschouwing mogen laten bij het vaststellen van de maximumprijs van de geneesmiddelen.
Wet geneesmiddelenprijzen. Regeling referentieprijslijsten geneesmiddelen (RRG). De minister heeft niet in strijd met artikel 1, aanhef en onder a, van de RRG de Tvz-lijst buiten beschouwing mogen laten bij het vaststellen van de maximumprijs van de geneesmiddelen. Geneesmiddel. Volgens de farmaceuten is het toepassen door de zorgverzekeraars van een preferentiebeleid ten aanzien van geneesmiddelen met bepaalde werkzame stoffen niet toegestaan. Niet voldaan is aan het relativiteitsvereiste (art. 6:163 BW) omdat, voorshands geoordeeld, art. 2.8 Besluit zorgverzekering niet strekt tot bescherming tegen de schade die de farmaceuten stellen te lijden. De voorzieningenrechter komt niet toe aan de beantwoording van de vraag of en in hoeverre het beweerde handelen in strijd met het Besluit zorgverzekering door de zorgverzekeraars bijdraagt tot het oordeel dat een zorgvuldigheidsnorm is geschonden die wèl bescherming biedt tegen de schade zoals de farmaceuten die (zullen gaan) lijden. Aan de farmaceuten wordt feitelijk geen effectieve rechtsbescherming onthouden. Vorderingen worden afgewezen.
Geneesmiddel. Volgens de farmaceuten is het toepassen door de zorgverzekeraars van een preferentiebeleid ten aanzien van geneesmiddelen met bepaalde werkzame stoffen niet toegestaan. Niet voldaan is aan het relativiteitsvereiste (art. 6:163 BW) omdat, voorshands geoordeeld, art. 2.8 Besluit zorgverzekering niet strekt tot bescherming tegen de schade die de farmaceuten stellen te lijden. De voorzieningenrechter komt niet toe aan de beantwoording van de vraag of en in hoeverre het beweerde handelen in strijd met het Besluit zorgverzekering door de zorgverzekeraars bijdraagt tot het oordeel dat een zorgvuldigheidsnorm is geschonden die wèl bescherming biedt tegen de schade zoals de farmaceuten die (zullen gaan) lijden. Aan de farmaceuten wordt feitelijk geen effectieve rechtsbescherming onthouden. Vorderingen worden afgewezen. Geneesmiddel. Maximumprijs. Bij besluit van 19 februari 2009 heeft de minister de bijlage bij de
Geneesmiddel. Maximumprijs. Bij besluit van 19 februari 2009 heeft de minister de bijlage bij de  Bij besluit van 15 april 1999 heeft het College de aanvraag van ARTU tot inschrijving van het middel Oralgen Pollen, druppelvloeistof, in het register van farmaceutische specialités, afgewezen.
Bij besluit van 15 april 1999 heeft het College de aanvraag van ARTU tot inschrijving van het middel Oralgen Pollen, druppelvloeistof, in het register van farmaceutische specialités, afgewezen. Intrekking van de handelsvergunning voor een homeopatisch zelfzorggeneesmiddel met therapeutische indicatie op de verpakking en in de bijsluiter op grond van
Intrekking van de handelsvergunning voor een homeopatisch zelfzorggeneesmiddel met therapeutische indicatie op de verpakking en in de bijsluiter op grond van 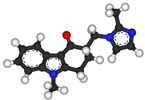 Uitspraak ingezonden door Ruprecht Hermans,
Uitspraak ingezonden door Ruprecht Hermans, 
















