Klager is klachtengeld verschuldigd
Vzr. RCC 9 oktober 2012, dossiernr. 2012-00897, 2012-00898, 2012-00899, 2012-00900, 2012-00901, 2012-00902 (Klager tegen adverteerder)
 Reclamerecht. Klacht als beroepsbeoefenaar met commercieel belang. Procesrecht. Klager heeft met online klachtenformulier bezwaar gemaakt tegen een reclame-uiting van adverteerder. De klacht betreft de volgens klager onjuiste mededeling op de website van adverteerder dat beide mondhygiënisten zijn afgestudeerd aan het ACTA. Klager heeft op het klachtenformulier meegedeeld de klacht als particulier in te dienen. Als adres is postbus 19 te Wolvega opgegeven. Navraag bij PostNL heeft uitgewezen dat dit postbusnummer op naam staat van Tandzorg Klinieken te Steenwijk.
Reclamerecht. Klacht als beroepsbeoefenaar met commercieel belang. Procesrecht. Klager heeft met online klachtenformulier bezwaar gemaakt tegen een reclame-uiting van adverteerder. De klacht betreft de volgens klager onjuiste mededeling op de website van adverteerder dat beide mondhygiënisten zijn afgestudeerd aan het ACTA. Klager heeft op het klachtenformulier meegedeeld de klacht als particulier in te dienen. Als adres is postbus 19 te Wolvega opgegeven. Navraag bij PostNL heeft uitgewezen dat dit postbusnummer op naam staat van Tandzorg Klinieken te Steenwijk.
De voorzitter van oordeel dat klager de klacht indient in het belang van de uitoefening van een bedrijf of beroep dan wel in een commercieel belang van een organisatie, zonder dat dit uit de klacht blijkt. De Voorzitter bepaalt dat klager klachtengeld ten bedrage van € 1.000,- verschuldigd is. Het klachtengeld dient binnen veertien dagen na dagtekening van deze beslissing in het bezit te zijn van de Stichting Reclame Code.
Een octrooi en certificaat voor ieder van de beschermde producten
Rechtbank ´s-Gravenhage 12 oktober 2012, reg.nr. AWB 10/4769 (Georgetown University tegen NL Octrooicentrum)
.gif) Octrooirecht. ABC. Eén van kracht zijnd basisoctrooi dat meerdere producten beschermt, en dat aan de houder van het basisoctrooi een certificaat wordt afgegeven voor ieder van de beschermde producten. Na de heropening IEF 11581, waar de rechtbank van oordeel was dat het onderzoek niet volledig is geweest en heropend dient te worden, nu een verwijzingsuitspraak waarin de rechtbank de volgende vijf vragen stelt.
Octrooirecht. ABC. Eén van kracht zijnd basisoctrooi dat meerdere producten beschermt, en dat aan de houder van het basisoctrooi een certificaat wordt afgegeven voor ieder van de beschermde producten. Na de heropening IEF 11581, waar de rechtbank van oordeel was dat het onderzoek niet volledig is geweest en heropend dient te worden, nu een verwijzingsuitspraak waarin de rechtbank de volgende vijf vragen stelt.
Vraag 1 Verzet Verordening 469/2009 van het Europees Parlement en de Raad van 6 mei 2009 betreffende het aanvullende beschermingscertificaat voor geneesmiddelen, meer in het bijzonder artikel 3, aanhef en onder c daarvan, zich ertegen dat, in de situatie dat een van kracht zijnd basisoctrooi meerdere producten beschermt, aan de houder van het basisoctrooi een certificaat wordt afgegeven voor ieder van de beschermde producten?
Vraag 2 Indien de eerste vraag bevestigend moet worden beantwoord, hoe dient artikel 3, aanhef en onder c, van de Verordening te worden uitgelegd in de situatie dat een van kracht zijnd basisoctrooi meerdere producten beschermt en op de aanvraagdatum van een certificaat voor één van de door het basisoctrooi beschermde producten (A), weliswaar nog geen certificaten waren verkregen voor andere producten (B, C) beschermd door hetzelfde basisoctrooi, doch op die aanvragen voor de producten (B, C) certificaten zijn afgegeven voordat op de aanvrage voor een certificaat voor het eerstgenoemde product (A) is beslist?
Vraag 3 Is het voor de beantwoording van de vorige vraag van belang of de aanvrage voor één van de door het basisoctrooi beschermde producten (A) op dezelfde datum is ingediend als de aanvragen voor andere producten (B, C) beschermd door hetzelfde basisoctrooi?
Vraag 4 Indien de eerste vraag bevestigend moet worden beantwoord, kan een certificaat worden afgegeven voor een door een van kracht zijnd basisoctrooi beschermd product, indien reeds eerder voor een ander door hetzelfde basisoctrooi beschermd product een certificaat is afgegeven, maar van dit laatste certificaat door de aanvrager afstand wordt gedaan met het oogmerk een nieuw certificaat te kunnen verkrijgen op basis van hetzelfde basisoctrooi?
Vraag 5 Indien het voor beantwoording van de vorige vraag relevant is of de afstand terugwerkende kracht heeft, wordt de vraag of afstand terugwerkende kracht heeft beheerst door artikel 14, aanhef en onder b, van de Verordening of door het nationale recht? Indien de vraag of afstand terugwerkende kracht heeft wordt beheerst door artikel 14, aanhef en onder b, van de Verordening, dient die bepaling zo te worden uitgelegd dat afstand terugwerkende kracht heeft?
Royal Canin is zo gezond voor kat en hond
CVB 17 oktober 2012, dossiernr. 2012/00557 (klager tegen adverteerder)

De klacht luidt als volgt. De reclame-uiting is misleidend omdat niet is bewezen dat Royal Canin gezond is. In Royal Canin zijn veel bewerkte granen verwerkt, die voor honden en katten flinke gezondheidsproblemen kunnen opleveren, zoals huidaandoeningen en coeliakie.
De adverteerder voert aan dat alle Royal Canin voedingen met de zorgvuldigheid worden geproduceerd volgens de wetenschappelijke inzichten en praktijkervaringen van professionals.
De Commissie vond de reclame-uiting te bestempelen als een misleidend omdat Royal Canin tekort schiet in de bewijslast van de absolute claim op "gezond voor kat en hond."
Het College vernietigt de beslissing van de Commissie en wijst de klacht alsnog af. In de uiting worden de voordelen van de diervoeding van Royal Canin (“zo gezond” in combinatie met de mededeling dat men daarom premierestitutie van genoemde verzekeraar krijgt) concreet en specifiek benoemd.
Grief 1
De Commissie heeft een onjuiste betekenis toegekend aan de verwijzing in de commercial naar de “gezondheid” van de diervoeding van Royal Canin. Er is geen sprake van een (te) absolute claim over de gezondheid van haar producten. De mededeling “zo gezond dat u (…) korting krijgt” zegt feitelijk niets over de gezondheid van het product. De gemiddelde consument zal deze woorden ook niet opvatten als een absolute claim over de gezondheid van de producten van Royal Canin, nu de consument gewend is aan de gangbare, legitieme reclamepraktijk waarbij overdreven uitspraken worden gedaan. Ten onrechte gaat de Commissie ervan uit dat bedoelde woorden voor Royal Canin de verplichting zouden meebrengen om aannemelijk te maken dat haar voeding gezond is. De gemiddelde consument zal op grond van bedoelde mededelingen hooguit in de veronderstelling verkeren dat Royal Canin het belang erkent en benadrukt van verantwoorde, gezonde voeding bij honden en katten, en dat Proteq daarom bereid is om premierestitutie korting te geven aan verzekeringnemers die hun pup of kitten voeden met Royal Canin.
Grief 2
Voor zover van de uiting al enige suggestie uitgaat ten aanzien van de mate van gezondheid van de diervoeding van Royal Canin, wordt deze suggestie duidelijk waargemaakt. In de bedrijfsfilosofie staat het gezondheidsbelang van de hond en de kat centraal. De ontwikkeling van de diervoeding van Royal Canin is gebaseerd op de laatste stand van de wetenschap met betrekking tot de voedingsbehoeften van honden en katten. Daarbij wordt onderzoek uitgevoerd door het Royal Canin Research & Development Center in nauwe samenwerking met enkele toonaangevende universiteiten. Ook is er een intensieve samenwerking met experts, zoals fokkers en dierenartsen. Al deze kennis heeft zich vertaald in de voeding van Royal Canin. De voedingswaarden daarvan voldoet ruimschoots aan de standaarden van de European Pet Food Industry Federation en het rapport Nutriënt Requirements of Cats and Dogs. Het assortiment van Royal Canin is zeer gedifferentieerd en de producten zijn goed verteerbaar. Royal Canin speelt een leidende rol bij dit laatste. Royal Canin legt uittreksels over van wetenschappelijke publicaties van enkele onderzoeken naar verteerbaarheid bij honden waarbij het Royal Canin Research & Development Center betrokken is geweest . Veel experts bevestigen de kwaliteit van voeding van Royal Canin, waaronder Proteq en dierenartsen. De stelling van geïntimeerde dat Royal Canin niet gezond zou zijn, is ongefundeerd.
1. Het College stelt voorop dat in de uiting door de woorden “Royal Canin is zo gezond voor kat en hond dat u voortaan korting krijgt van de grootste huisdierverzekeraar Proteq Dier en Zorg” onmiskenbaar een verband wordt gelegd tussen diervoeding van Royal Canin en de gezondheid van kat en hond. Van kennelijke overdrijving is daarbij geen sprake. In de uiting worden immers de voordelen van de diervoeding van Royal Canin (“zo gezond” in combinatie met de mededeling dat men daarom premierestitutie van genoemde verzekeraar krijgt) concreet en specifiek benoemd.
Automatically recognised by Liechtenstein, is first authorisation?
Prejudiciële vragen aan HvJ EU High Court of Justice, Chancery Division, Patents Court 19 oktober 2012 [2012] EWHC 2840 (Pat) (Astrazeneca AB tegen Comptroller General of Patents, Designs and Trade Marks) - Nederlandse vertaling
 Prejudiciële vragen gesteld door High Court of Justice, Chancery Division, Patents Court, Engeland & Wales, Verenigd Koninkrijk.
Prejudiciële vragen gesteld door High Court of Justice, Chancery Division, Patents Court, Engeland & Wales, Verenigd Koninkrijk.
Octrooirecht. Aanvullende bescherming, ABC. Onder verwijzing naar HvJ EU C-127/00 (Hässle AB tegen Ratiopharm GmbH), C-207/03 en C-252/03 (Novartis tegen Comptroller), C-195/09, IEF 10019 (Synthon tegen Merz Pharma), C-130/11, IEF 11598 (Neurim tegen Comptroller) worden de volgende vragen gesteld.
Verzoekster heeft in 2004 van de Zwitserse autorieiten een voorwaardelijke (= het aantonen van de werking) vergunning voor het in de handel brengen van een werkzame stof voor behandeling van longkanker onder de merknaam ‘Iressa’. In 2005 wordt verhandeling van het middel geschorst.
In 2003 vraagt verzoekster bij het Europees Geneesmiddelenbureau (EMA) een vergunning voor het in de handel brengen voor Iressa op grond van Vo. 2309/93. Maar het daarvoor competente Comité wijst de aanvraag af wegens de nog onvoltooide studies naar de werking van het middel. Verzoekster trekt de aanvraag in en dient deze pas in 2008 opnieuw in. Het Europese vergunning voor het in de handel brengen wordt dan in juni 2009 verleend. Op basis daarvan vraagt en krijgt verzoekster opheffing van de schorsing van de Zwitserse vergunning voor het in de handel brengen.
Het voor het middel verkregen EUR octrooi zal in april 2016 vervallen. Verzoekster heeft een ABC aangevraagd maar partijen worden het niet eens over de vervaldatum daarvan. Verweerster (Comptroller-General of Patents, Designs and Trade Marks) gaat uit van de door het EMA verleende VHB van het medicijn in juni 2009, maar octrooibureaus in andere landen rekenen vanaf de Zwitserse vergunning voor het in de handel brengen.
De vraag die voor de verwijzende Engelse rechter moet worden beantwoord om deze zaak te kunnen oplossen is wat moet worden verstaan onder “eerste vergunning voor het in de handel brengen”. In deze zaak betreft het een automatisch door de Liechtensteinse aut verstrekte vergunning die dus niet voldoet aan de voorwaarden van Vo. 469/2009/EG.
1. Kan een Zwitserse vergunning voor het in de handel brengen, die niet werd verleend overeenkomstig de in richtlijn 2001/83/EG vastgestelde administratieve vergunningsprocedure maar door Liechtenstein automatisch wordt erkend, de „eerste vergunning voor het in de handel brengen” vormen voor de toepassing van artikel 13, lid 1, van verordening nr. 469/2009/EG?
2. Is het voor de beantwoording van de eerste vraag van belang of:
(a) de reeks klinische gegevens op grond waarvan de Zwitserse autoriteit de vergunning voor het in de handel brengen heeft verleend, volgens het Europees Geneesmiddelenbureau niet voldeed aan de voorwaarden voor de afgifte van een vergunning voor het in de handel brengen overeenkomstig verordening nr. 726/2004/EG; en/of
(b) de Zwitserse vergunning voor het in de handel brengen na afgifte werd geschorst en pas weer uitwerking kreeg nadat bijkomende gegevens waren overgelegd?
3. Indien artikel 13, lid 1, van verordening nr. 469/2009 enkel verwijst naar vergunningen voor het in de handel brengen die zijn verleend overeenkomstig de in richtlijn 2001/83/EG vastgestelde administratieve vergunningsprocedure, heeft het feit dat een geneesmiddel eerst binnen de EER in de handel werd gebracht overeenkomstig een door Liechtenstein automatisch erkende Zwitserse vergunning voor het in de handel brengen, die niet werd verleend overeenkomstig richtlijn 2001/83/EG, dan tot gevolg dat overeenkomstig artikel 2 van verordening nr. 469/2009 voor dit product geen aanvullend beschermingscertificaat kan worden afgegeven?
Op andere blogs:
The SPC Blog (SPCs and Directive 2001/83-compliant authorisations: a comment on AstraZeneca)
The SPC Blog (Breaking news: Swiss/Liechtenstein questions head for CJEU)
Facturen op basis regeling retributies vetinaire en hygiënische aangelegenheden is een Awb-besluit
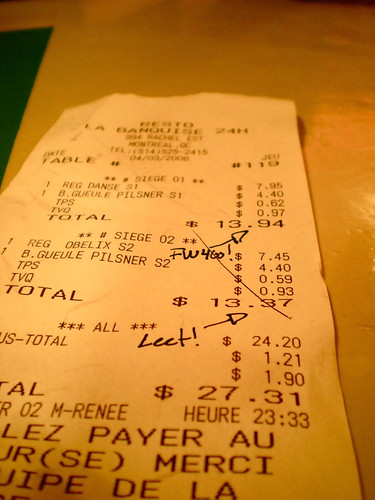 Als randvermelding. Facturen van de Staat op basis van de Regeling retributies veterinaire en hygiënische aangelegenheden hebben als besluit in de zin van de Awb te gelden. De facturen van de Staat hebben formele rechtskracht nu daartegen geen bezwaar is gemaakt in de zin van de Awb. Rechtbank veroordeelt gedaagde tot de betaling van de openstaande facturen. Ook de eisen van redelijkheid en billijkheid brengen niet met zich mee dat gedaagde niet het hele gevorderde bedrag zou hoeven te betalen.
Als randvermelding. Facturen van de Staat op basis van de Regeling retributies veterinaire en hygiënische aangelegenheden hebben als besluit in de zin van de Awb te gelden. De facturen van de Staat hebben formele rechtskracht nu daartegen geen bezwaar is gemaakt in de zin van de Awb. Rechtbank veroordeelt gedaagde tot de betaling van de openstaande facturen. Ook de eisen van redelijkheid en billijkheid brengen niet met zich mee dat gedaagde niet het hele gevorderde bedrag zou hoeven te betalen.
9. Er is naar het oordeel van de rechtbank geen reden om een uitzondering te maken op de formele rechtskracht van de facturen. Slechts in zeer bijzondere gevallen kan er reden zijn om een uitzondering te maken. Daarvan kan sprake zijn als het aan de overheid valt toe te rekenen dat een belanghebbende heeft verzuimd tegen een besluit op te komen, bijvoorbeeld als de overheid zelf de schijn heeft gewekt dat sprake is van een rechtshandeling naar burgerlijk recht.
Daarvan is in casu geen sprake. Op elke factuur stond op de achterkant juist dat daartegen, binnen zes weken, bezwaar kon worden gemaakt bij het Ministerie van Landbouw. Ook anderszins is het niet aan de VWA te wijten dat [gedaagde] geen bezwaar heeft gemaakt.
Dat er ook betalingsvoorwaarden op de achterzijde van de factuur staan, maakt dat niet anders. Indien [gedaagde] op grond daarvan al twijfelde aan de vraag of er wel sprake was van een besluit, had hij daarnaar kunnen informeren en zekerheidshalve (pro-forma) bezwaar kunnen maken.I. Veroordeelt [gedaagde] om aan de Staat tegen behoorlijk bewijs van kwijting te voldoen een bedrag van € 12.047,72, te vermeerderen met de wettelijke rente over € 11.526,94 vanaf 10 mei 2011 tot aan de dag der algehele voldoening, respectievelijk, voor zover facturen dateren van na de dag der dagvaarding, vanaf vier weken na factuurdatum tot aan de dag der algehele voldoening.
II. Veroordeelt [gedaagde] in (een deel van) de proceskosten van de Staat, die worden berekend op € 1.280,26 wegens verschotten.
Spagyrische kruidenessences zijn geneesmiddel
CBB 14 september 2012, LJN BY0502 (SIWOS tegen Minister VWS)
 Spagyrische kruidenessences zoals hier in geding kunnen op grond van het aandieningscriterium als geneesmiddel worden aangemerkt.
Spagyrische kruidenessences zoals hier in geding kunnen op grond van het aandieningscriterium als geneesmiddel worden aangemerkt.
In citaten:
2.2 (...) De minister had naar het oordeel van het College feitelijk onderzoek moeten verrichten naar de vraag of de spagyrische producten als geneesmiddel moeten worden aangemerkt, ten einde te kunnen bepalen of het Warenwetbesluit Kruidenpreparaten van toepassing is en een ontheffing van het daarin neergelegde handelsverbod aan de orde kan zijn. Zonder nader onderzoek naar (onder andere de etikettering, bestemming, distributiekanalen van) de spagyrische producten kan de minister, in elk geval ten tijde hier van belang, niet concluderen dat het Warenwetbesluit Kruidenpreparaten niet van toepassing is.
Het College heeft vervolgens de uitspraak van de rechtbank van 13 januari 2006 (www.rechtspraak.nl: LJN AV008) vernietigd, de beslissing op bezwaar van 7 februari 2005 vernietigd en de minister opgedragen met inachtneming van de uitspraak opnieuw op het bezwaar van SIWOS te beslissen.
4.2 Volgens de minister is sprake van een geneesmiddel, nu het etiket duidelijk vermeldt dat het om spagyrische kruidenessences gaat. De vermelding van het bijvoeglijk naamwoord spagyrisch vormt een belangrijk onderscheid met andere kruidenessences. Het maakt duidelijk dat het product tot doel heeft een spagyrische behandeling mogelijk te maken. De spagyriek is volgens de minister een geneeswijze. Het richt zich op de aard en de oorzaken van ziekten en op de middelen om die te genezen. Een zoektocht via Google naar het begrip spagyriek geeft voornamelijk treffers van sites die gericht zijn op of informatie geven over het genezen van ziekten. De producent van de kruidenessences Phylak Sachsen, een in Duitsland gevestigd farmaceutisch bedrijf, heeft aldaar een vergunning voor het verhandelen van deze producten als geneesmiddel. Op de website van Phylaks Sachsen worden de spagyrische kruidenessences aangeprezen als zijnde bestemd voor de oorzakelijke behandeling van ziekten. Blijkens het arrest Ter Voort van het Hof van Justitie van de EG (hierna: Hof van Justitie) van 28 oktober 1992 (Zaak C-219/91, Jur. 1992 blz. I-5485) kunnen de gedragingen, initiatieven en handelingen van de fabrikant of de verkoper, waaruit diens bedoeling blijkt bij de met een gemiddeld onderscheidingsvermogen begiftigde consument de indruk wekken dat het door hem verhandelde product een geneesmiddel is, bepalend zijn voor de vraag of een product op grond van zijn aandiening als geneesmiddel moet worden aangemerkt.
Voorts heeft de minister gewezen op de internetsite Primateria, waar de spagyrische kruidenessences van Phylak Sachsen worden verkocht. Op die site is een overzicht te vinden van Nederlandse natuurgenezers, artsen en therapeuten die werken met deze producten. Het betreft personen die in de regel geneesmiddelen voorschrijven.
De minister heeft ook gewezen op de statuten van SIWOS, waaruit blijkt dat SIWOS spagyriek als een tak van de medische wetenschap aanmerkt.
Aanpassing van het etiket maakt volgens de minister niet dat geen sprake meer is van een geneesmiddel. Ook dan wordt immers informatie verstrekt (door o.a. artsen) over het spagyrische karakter.
5.3 Het College is op grond van de gedingstukken (...) en het verhandelde ter zitting van oordeel dat in het onderhavige geval is voldaan aan het aandieningscriterium, in de zin dat bij de met een gemiddeld onderscheidingsvermogen begiftigde consument door de wijze van aandiening de indruk wordt gewekt dat de producten van SIWOS een therapeutische (of profylactische) werking hebben met betrekking tot ziekten. De navolgende omstandigheden in onderlinge samenhang bezien brengen het College tot dit oordeel.
SIWOS heeft gesteld dat de producten zullen worden verkocht in flesjes voorzien van een etiket. Naast de informatie waartoe artikel 6, tweede lid, van het Warenwetbesluit Kruidenpreparaten verplicht, zal op het etiket in ieder geval worden verwezen naar spagyriek, zo heeft SIWOS ter zitting verklaard. Uit de stukken en het door SIWOS ter zitting verklaarde ten aanzien van de werking van spagyriek volgt voorts dat met spagyriek beoogd wordt de oorzaken van ziektes weg te nemen en daarmee als (mogelijk) bijgevolg de ziekte zelf. Daarnaast blijkt uit de statuten van SIWOS dat zij spagyriek als een tak van medische wetenschap beschouwt. Voorts wordt in de voor een ieder toegankelijke informatie van de fabrikant Phylak Sachsen Gmbh – die op het etiket van de flesjes zal worden vermeld –spagyriek geduid als een geneeswijze. Deze fabrikant stelt op zijn website dat spagyrische kruidenessences zijn bestemd voor de behandeling van ziekten: “Spagyrische Essenzen bewaehren sich bestens bei der ursaechlichen Behandlung bestimmter Krankheiten”.
SIWOS heeft voorts betoogd dat voorschrijvers zoals natuurgenezers, artsen en therapeuten, respectievelijk apothekers, drogisten en andere verstrekkers de betreffende consument zullen voorlichten over de specifieke spagyrische eigenschappen van de producten van SIWOS. Ook dat draagt naar het oordeel van het College eraan bij dat bij de consument de indruk wordt gewekt dat het hier om een geneesmiddel gaat. Weliswaar heeft SIWOS in beroep spagyriek als heelmethode geduid, maar dat kan – wat daar ook van zij – gezien de vorenstaande feitelijke omstandigheden er niet aan afdoen dat door de wijze van aandiening de indruk wordt gewekt dat de producten van SIWOS een therapeutische (of profylactische) werking hebben.
5.4 Nu aan het aandieningscriterium als bedoeld in artikel 1, aanhef en onder e, van de WOG is voldaan, gelden de producten hier in geding als geneesmiddel en is het Warenwetbesluit Kruidenpreparaten niet van toepassing (artikel 1, tweede lid, onder deel b). Verweerder heeft SIWOS in haar verzoek terecht niet-ontvankelijk verklaard.
5.5 De stelling dat de firma Jacob Hooy wel ontheffing op grond van het Kruidenbesluit heeft verkregen en als een gelijk geval moet worden beschouwd, heeft SIWOS niet onderbouwd. Een beroep op het gelijkheidsbeginsel slaagt reeds hierom niet.
Voor zover SIWOS heeft betoogd dat het onderzoek van het RIVM waartoe de minister opdracht heeft gegeven naar aanleiding van de uitspraak van het College van 20 december 2007 ontoereikend is geweest, oordeelt het College dat de minister in zijn brief van 18 maart 2008 aan SIWOS vragen heeft gesteld die betrekking hebben op het aandieningscriterium. Naar het oordeel van het College heeft de minister daarmee voldaan aan de door het College in de uitspraak van 20 december 2007 in rubriek 5.4 weergegeven opdracht te onderzoeken of de producten van SIWOS als geneesmiddel moeten worden aangemerkt.
De discussie over de veredelingstechnieken

 Nederland is van mening dat een vrijstelling van de EU ggo wet- en regelgeving alleen tot de mogelijkheden behoort wanneer een bepaalde techniek, in dit geval cisgenese, producten voortbrengt die niet meer risico’s met zich meebrengen dan traditioneel veredelde gewassen. Bij een vrijstelling vervalt naast de etiketteringsplicht namelijk ook de plicht tot een risicobeoordeling in het kader van de EU ggo wet- en regelgeving. Een vrijstelling van cisgenese van de ggo wet- en regelgeving laat onverlet dat een beoordeling van de voedselveiligheid van cisgene producten moet plaatsvinden uit hoofde van de Nieuwe voedingsmiddelen verordening (EG) 258/97.
Nederland is van mening dat een vrijstelling van de EU ggo wet- en regelgeving alleen tot de mogelijkheden behoort wanneer een bepaalde techniek, in dit geval cisgenese, producten voortbrengt die niet meer risico’s met zich meebrengen dan traditioneel veredelde gewassen. Bij een vrijstelling vervalt naast de etiketteringsplicht namelijk ook de plicht tot een risicobeoordeling in het kader van de EU ggo wet- en regelgeving. Een vrijstelling van cisgenese van de ggo wet- en regelgeving laat onverlet dat een beoordeling van de voedselveiligheid van cisgene producten moet plaatsvinden uit hoofde van de Nieuwe voedingsmiddelen verordening (EG) 258/97.
De COGEM heeft in 2009 aangegeven dat zij vanuit milieuveiligheid geen bezwaren heeft tegen een vrijstelling van cisgenese4. Het toenmalige Ministerie van VROM heeft vervolgens het RIKILT-Instituut voor Voedselveiligheid gevraagd te adviseren over de voedsel- en diervoederveiligheid van cisgenese.
Dit RIKILT rapport van 2010 gaf in de TK aanleiding tot discussie en leidde tot een motie van mevr. Wiegman van Meppelen Scheppink c.s. waarin de regering werd verzocht om plantenwetenschappers onderzoek te laten doen naar de risico’s vergeleken met traditionele veredeling en het RIKILT rapport als voorlopig rapport te beschouwen. Nederland heeft vervolgens de Europese Commissie verzocht om EFSA te mandateren om te adviseren over de veiligheid (voedsel-, diervoeder- en milieuveiligheid) van cisgene gewassen en daarbij een vergelijking te maken met traditionele veredeling en de expertise van plantveredelaars te betrekken. Dit rapport is begin van dit jaar verschenen [Kamerstukken II, 2010-2011, 32 500, Nr. 122]. Hierin is het RIKILT rapport meegenomen en hebben wetenschappers van het RIKILT deelgenomen aan de EFSA werkgroep onder het GMO-panel, dat het advies over cisgenese heeft opgesteld.
Ik heb kennisgenomen van de standpunten van verschillende betrokken partijen in Nederland ten aanzien van cisgenese. Hieruit maak ik op dat de veredelingsbedrijven cisgenese beschouwen als een techniek die vergelijkbaar is met traditionele veredeling maar die tevens efficiënter is. Op basis hiervan en op basis van het EFSA advies zijn zij van mening dat het vrijstellen van cisgenese van de EU ggo wet- en regelgeving verantwoord is. De ketenorganisatie voor de biologische landbouw en de milieubeweging Greenpeace vinden echter dat cisgenese gelijk is aan genetische modificatie en de producten als zodanig moeten worden beoordeeld. Zij hechten waarde aan keuzevrijheid voor (biologische) telers en consumenten.
(...) Consumenten die geen producten willen consumeren van vrijgestelde nieuwe veredelingstechnieken kunnen zo terecht bij producten van de biologische landbouw. Op deze wijze waarborgt de Nederlandse regering keuzevrijheid voor producent en consument en is er voldoende ruimte voor zowel de conventionele landbouw als de biologische landbouw om binnen de eigen kaders te opereren.
De discussie over de veredelingstechnieken is een belangrijke discussie. Nederland heeft zich de afgelopen jaren sterk gemaakt om op EU niveau duidelijkheid te verschaffen over de status van deze technieken in relatie tot de ggo wet- en regelgeving. De Nederlandse regering stelt zich op het standpunt dat overregulering voorkomen moet worden en de kansen gegrepen moeten worden die de nieuwe veredelingstechnieken bieden.
Merken- en gezondheidsautoriteiten meer op een lijn
 Een bijdrage van Corina Wolfert, Merkenbureau Abcor.
Een bijdrage van Corina Wolfert, Merkenbureau Abcor.
Het Australische merkenbureau gaat voortaan farmaceutische, veterinaire of pesticide merknamen uit klasse 5 weigeren die mede bestaan uit een INN stem in het geval dat deze misleidend zijn of verwarring veroorzaken. Is dit een goed ontwikkeling of moet deze beoordeling alleen aan de gezondheidsautoriteiten overlaten?
INN staat voor International Nonproprietary Name oftewel de stofnaam van een medicijn. Een voorbeeld van een INN of stofnaam is bijvoorbeeld Desloratadine; een antihistaminicum dat de symptomen van hooikoorts tegen gaat. De merknamen van dit hooikoorts geneesmiddel zijn bijvoorbeeld NeoClarityn, Claramax, Clarinex en Aerius.Een stofnaam zoals Desloratadine kan niet als merk worden geregistreerd omdat deze naam vrij moet zijn in gebruik.
Medicijnen die uit dezelfde therapeutische groep of chemische klasse komen, hebben over het algemeen eenzelfde soort woordelement in hun stofnaam. Dit element noemen we een “stem”. Dus de stofnaam Desloratadine komt uit de therapeutisch groep van Histamine-H1 recepteptor antagonisten. Alle stofnamen uit deze groep eindigen op –tadine. De INN stem van desloratadine is dus TADINE.
Wordt TADINE gebruikt in een merknaam dat niet als anti hooikoorts middel bedoelt is, dan is dit misleidend en zal het merk in Australië door het merkenbureau geweigerd gaan worden. Dit is op zich een goede ontwikkeling omdat dit in lijn ligt met de voorschriften van de World Health Organization (WHO). Dus deze manier van beoordelen komt niet zomaar uit de lucht vallen. In de algemene richtsnoer van de WHO staat dat de veiligheid van de patiënt gewaarborgd moet worden en merken niet afgeleid mogen zijn van de INN naam of van de INN stem. In theorie gaan de WHO richtsnoeren dus zelfs nog een stapje verder, maar dit wordt in de praktijk niet op deze manier uitgevoerd. Gezondheidsautoriteiten oordelen meer op de manier zoals de Australische merkautoriteiten van plan zijn te gaan doen.
De meeste INN stems bestaan uit meerdere lettergrepen maar er zijn ook korte INN stems zoals –al, -dan, -ast, -ine, –kin etc. Het ligt dan aan de lengte van het merk en hoe deze is opgebouwd of het een dergelijk woordelement als INN wordt opgemerkt. Het element kin dat wordt gebruikt als “skin” zal niet als een INN stem opgevat worden. Het is op zich een goede ontwikkeling dat de merkenautoriteit dezelfde regeling toepast als een gezondheidsautoriteit. De houder van het farmamerk kan beter in een vroeger stadium een afwijzing van zijn merk krijgen als in het stadium van productregistratie. Waar wel rekening mee gehouden moet worden, is dat een merkenautoriteit op de stoel gaat zitten van een gezondheidsautoriteit. Het is de vraag in hoeverre een merkenautoriteit in staat is eenzelfde oordeel te vellen als iemand met een medische achtergrond bij een gezondheidsautoriteit. Het is daarom aan te raden dat een merkenautoriteit samenwerkt met de eigen gezondheidsautoriteit als het gaat om de beoordeling van farmaceutische merknamen.
Bij de Benelux merkenautoriteiten noch bij de Europese merkenautoriteiten speelt deze discussie en worden merknamen niet op INN stems gecheckt. We houden de ontwikkeling in Australië nauwlettend in de gaten aangezien deze manier van merkbeoordeling snel over kan slaan naar Europa.
Corina Wolfert
Amfetamine-achtig poeder is geen amfetamine
Hof 's-Hertogenbosch 12 oktober 2012, LJN BY0035 (amfetamine-achtige poeder)
 Fluoramfetamine staat niet vermeld op één van de lijsten behorende bij de Opiumwet. Het hof acht het waarschijnlijker dat verdachte poeder bevattende fluoramfetamine heeft afgeleverd en vervoerd dan dat hij poeder bevattende amfetamine heeft afgeleverd en vervoerd. Dat gebruikers het afgeleverde poeder amfetamine noemden doet daar niet aan af, nu ook fluoramfetamine een stimulerend en euforiserend effect heeft, vergelijkbaar met dat van amfetamine-achtigen. Volgt vrijspraak ter zake van overtreding van artikel 2 van de Opiumwet.
Fluoramfetamine staat niet vermeld op één van de lijsten behorende bij de Opiumwet. Het hof acht het waarschijnlijker dat verdachte poeder bevattende fluoramfetamine heeft afgeleverd en vervoerd dan dat hij poeder bevattende amfetamine heeft afgeleverd en vervoerd. Dat gebruikers het afgeleverde poeder amfetamine noemden doet daar niet aan af, nu ook fluoramfetamine een stimulerend en euforiserend effect heeft, vergelijkbaar met dat van amfetamine-achtigen. Volgt vrijspraak ter zake van overtreding van artikel 2 van de Opiumwet.
Aan verdachte is ten laste gelegd dat:
hij in of omstreeks de periode van 1 november 2009 tot en met 31 maart 2010 te Veldhoven, althans binnen Nederland, meermalen, althans eenmaal (telkens) opzettelijk heeft verkocht en/of afgeleverd en/of verstrekt en/of vervoerd, in elk geval (telkens) opzettelijk aanwezig heeft gehad, een hoeveelheid van een materiaal bevattende amfetamine, zijnde amfetamine een middel als bedoeld in de bij de Opiumwet behorende lijst I, dan wel aangewezen krachtens het vijfde lid van artikel 3a van die wet.
B.2
Door het Nederlands Forensisch Instituut is het in de woning van medeverdachte [medeverdachte] aangetroffen poeder onderzocht. Uit dit onderzoek bleek dat dit poeder geen amfetamine, bevatte doch fluoramfetamine. Fluoramfetamine staat niet vermeld op één van de lijsten behorende bij de Opiumwet.Gelet hierop acht het hof het waarschijnlijker dat verdachte poeder (eveneens) bevattende fluoramfetamine heeft afgeleverd en vervoerd dan dat hij poeder bevattende amfetamine heeft afgeleverd en vervoerd.
Dat gebruikers het afgeleverde poeder amfetamine noemden doet daar niet aan af, nu ook fluoramfetamine een stimulerend en euforiserend effect heeft, vergelijkbaar met dat van amfetamine-achtigen.
B.4
Gelet op het vorenstaande schiet naar het oordeel van het hof het voorhanden bewijs ervoor tekort dat verdachte een hoeveelheid van een materiaal bevattende amfetamine heeft verkocht, afgeleverd, verstrekt, vervoerd dan wel aanwezig heeft gehad, zodat hij zal worden vrijgesproken van het hem ten laste gelegde.Het Hof verklaart niet bewezen dat de verdachte het ten laste gelegde heeft begaan en spreekt hem daarvan vrij.
Vragenlijst over waardering geneesmiddel valt onder reclame
CGR 27 september 2012, Advies AA12.075
Reclame. Onderzoek wetenschappelijk verantwoord. Vragenlijst.
Wereldwijd lijden volgens opgave van [X] naar schatting 300 miljoen mensen aan [aandoening B]. Het doel van het onderzoek is vast te stellen aan welk middel, [C] of een eerder door de patiënt gebruikt concurrerend middel, de voor [aandoening B] behandelde patiënten de voorkeur geven in de dagelijkse praktijk. Dit onderzoek wordt gedaan met een vragenlijst waarop de patiënt op een schaal van zeven kan aangeven hoe hij het gebruik van [middel C] in de onderzoeksperiode waardeert ten opzichte van een eerder door hem gebruikt vergelijkbaar geneesmiddel.
Door de wijze waarop dit onderzoek wordt uitgevoerd en het betreffende geneesmiddel daardoor onder de aandacht van artsen wordt gebracht kan onder omstandigheden sprake zijn van reclame voor dat geneesmiddel. Blijkens de Gedragscode Geneesmiddelen Reclame wordt onder reclame verstaan: iedere aanprijzing van geneesmiddelen en daarmee samenhangende diensten of denkbeelden, daaronder begrepen het aanbieden of vragen van diensten of goederen in de omgang tussen vergunninghouders en beroepsbeoefenaren. Dergelijke onderzoeken zijn daarom slechts toelaatbaar indien de dienst die van de arts tegen beloning voor zijn medewerking wordt gevraagd “van belang is voor de uitoefening van de geneeskunst, de farmacie, de tandheelkunst of de verloskunst” (art. 94 onder a Geneesmiddelenwet) en indien het betreffende onderzoek niet leidt tot ”irrationeel voorschrijfgedrag” (art. 5 onder b Uitwerking). Het voorgenomen niet-WMO-plichtig onderzoek voldoet niet aan de eisen van de Gedragscode Geneesmiddelenreclame en 94a Geneesmiddelenwet.
2.4 Zowel ten aanzien van de vraag of deelname aan dit onderzoek door artsen die daarvoor een beloning ontvangen in het belang is van een goede uitoefening van de geneeskunde als ten aanzien van de vraag of de opzet van het onderzoek, afgezet tegen het belang van de geneeskunde bij dit onderzoek, voldoende wetenschappelijk verantwoord is zijn bij de Commissie ernstige bedenkingen gerezen die resulteren in een negatief advies.
De slotsom is dat het door [X] voorgenomen niet-WMO-plichtig onderzoek niet voldoet aan de eisen die de Gedragscode Geneesmiddelenreclame en artikel 94 a Geneesmiddelenwet aan een dergelijk onderzoek stellen.

















