Legal basis of the new Regulation medicated feed and at repealing
Opinion on the legal basis of the Manufacture, placing on the market and use of medicated feed and repealing Council Directive 90/167/EEC (COM(2014/0556 – C8-0143/2014 – 2014/0255(COD))  The scope of the proposed Regulation covers the manufacture, placing on the market and use of medicated feed in food-producing animals and in pets within the European Union7 . Recital 2 to the proposal states that "[l]ivestock production occupies a very important place in the agriculture of the Union. The rules concerning medicated feed have significant influence on the keeping and on the rearing of animals, including non-food producing animals, and on the production of products of animal origin."
The scope of the proposed Regulation covers the manufacture, placing on the market and use of medicated feed in food-producing animals and in pets within the European Union7 . Recital 2 to the proposal states that "[l]ivestock production occupies a very important place in the agriculture of the Union. The rules concerning medicated feed have significant influence on the keeping and on the rearing of animals, including non-food producing animals, and on the production of products of animal origin."
If adopted, the Regulation will repeal Council Directive 90/167/EEC. Recital 4 to the proposal specifies that "[e]xperience with the application of Directive 90/167/EEC has shown that further measures should be taken to strengthen the effective functioning of the Internal Market and to explicitly give and improve the possibility to treat non-food producing animals by medicated feed."
In this connection, the explanatory memorandum to the proposal states that "(t)he aim of the review of the medicated feed rules is to harmonise at a high safety level the manufacture, marketing and use of medicated feed and intermediate products in the EU and to reflect technical progress in this field", and furthermore stresses that "the existing legislation is likely to perpetuate existing discrepancies in its implementation between the Member States. This creates an uneven playing field for professional operators on the single market. There is a need to harmonise implementation of the legislation, reduce financial and administrative burdens and support innovation."
Bayer moet NOAC-notitie rectificeren
CGR 16 juni 2015, LS&R 1148; K15.002 (Boehringer Ingelheim tegen Bayer) Klacht gegrond. Vergelijkende reclame. BI brengt het geneesmiddel Pradaxa. Bayer brengt het geneesmiddel Xarelto (werkzame stof: rivaroxaban) in Nederland op de markt. Pradaxa en Xarelto behoren beide tot de nieuwe orale anticoagulantia (NOAC’s) en zijn rechtstreeks met elkaar concurrerende UR-geneesmiddelen. Bayer dient haar uiting die begin 2015 onder cardiologen is verspreid met de titel “Het dabigatran debacle” (“Notitie”) te rectificeren: Hierin wordt onder meer een vergelijking gemaakt met rivaroxaban en worden beschuldigingen geuit jegens Boehringer Ingelheim samengevat inhoudende dat zij willens en wetens informatie uit klinisch onderzoek zou hebben achtergehouden voor de registratieautoriteiten waaruit zou blijken dat dabigatran een hoger risico geeft op bloedingen dan met monitoring het geval zou kunnen zijn, althans dat Boehringer Ingelheim deze informatie grotendeels zou hebben gebagatelliseerd.
Klacht gegrond. Vergelijkende reclame. BI brengt het geneesmiddel Pradaxa. Bayer brengt het geneesmiddel Xarelto (werkzame stof: rivaroxaban) in Nederland op de markt. Pradaxa en Xarelto behoren beide tot de nieuwe orale anticoagulantia (NOAC’s) en zijn rechtstreeks met elkaar concurrerende UR-geneesmiddelen. Bayer dient haar uiting die begin 2015 onder cardiologen is verspreid met de titel “Het dabigatran debacle” (“Notitie”) te rectificeren: Hierin wordt onder meer een vergelijking gemaakt met rivaroxaban en worden beschuldigingen geuit jegens Boehringer Ingelheim samengevat inhoudende dat zij willens en wetens informatie uit klinisch onderzoek zou hebben achtergehouden voor de registratieautoriteiten waaruit zou blijken dat dabigatran een hoger risico geeft op bloedingen dan met monitoring het geval zou kunnen zijn, althans dat Boehringer Ingelheim deze informatie grotendeels zou hebben gebagatelliseerd.
De Codecommissie van de Stichting Code Geneesmiddelenreclame heeft in een uitspraak van 16 juni 2015 (K15.002) geoordeeld dat de Notitie als (vergelijkende)reclame moet worden beschouwd en dat:
de inhoud van de Notitie niet accuraat, waarheidsgetrouw en in zijn onderdelen juist en controleerbaar is en dat de daarin gemaakte vergelijking van de onderhavige middelen niet wetenschappelijk aantoonbaar juist en dus
misleidend is;
in de Notitie niet de omzichtigheid wordt betracht die ten opzichte branchegenoten geboden is, de Notitie niet voldoet aan de geldende normen van goede smaak en fatsoen, de Notitie afbreuk doet aan de reputatie van de farmaceutische industrie en haar producten, de Notitie onnodig afbreuk aan de waarde van dabigatran en dat Boehringer Ingelheim in de Notitie onnodig in diskrediet wordt gebracht;
er sprake is van een ernstige schending van de bepalingen van de Gedragscode Geneesmiddelenreclame.
Klinisch moleculair bioloog in pathologie geen beroepsbeoefenaar
CGR 8 mei 2015, LS&R 1147; AA15.039 (Klinisch moledulair bioloog in de pathologie) Definitie beroepsbeoefenaar. De Commissie volgt [X] niet in haar opvatting dat klinisch moleculair biologen in de pathologie naar analogie van art. 6.4.2 van de Gedragscode bij het verlenen van gastvrijheid als beroepsbeoefenaar kunnen worden beschouwd. Uit de omschrijving van de taken en verantwoordelijkheden van de klinisch moleculair biologen in de pathologie blijkt niet van enige betrokkenheid bij de toediening of verstrekking van een geneesmiddel aan een patiënt. Het advies is negatief.
Definitie beroepsbeoefenaar. De Commissie volgt [X] niet in haar opvatting dat klinisch moleculair biologen in de pathologie naar analogie van art. 6.4.2 van de Gedragscode bij het verlenen van gastvrijheid als beroepsbeoefenaar kunnen worden beschouwd. Uit de omschrijving van de taken en verantwoordelijkheden van de klinisch moleculair biologen in de pathologie blijkt niet van enige betrokkenheid bij de toediening of verstrekking van een geneesmiddel aan een patiënt. Het advies is negatief.
1.1 [X] meent dat het naar analogie van artikel 6.4.2. van de Gedragscode Geneesmiddelenreclame, krachtens welke bepaling bij het verlenen van gastvrijheid in het kader van bijeenkomsten onder beroepsbeoefenaren ook wordt verstaan een verpleegkundige die in de uitoefening van zijn beroep in opdracht van een arts, tandarts of verloskundige geneesmiddelen toedient of verstrekt aan patiënten, toelaatbaar moet zijn op dezelfde voet gastvrijheid te verlenen aan klinisch moleculair biologen in de pathologie.2.2 Slechts indien de klinisch moleculair biologen in de pathologie in opdracht van een arts zelf geneesmiddelen aan een patiënt zouden (mogen) toedienen of verstrekken zou er plaats zijn voor analoge toepassing van art. 6.4.2 van de Gedragscode. (...) Uit de omschrijving van de taken en verantwoordelijkheden van de klinisch moleculair biologen in de pathologie zoals die door [X] in haar verzoek zijn opgenomen blijkt niet van enige betrokkenheid van de klinisch moleculair biologen in de pathologie bij de toediening of verstrekking van een geneesmiddel aan een patiënt. Leest de Commissie een en ander goed dan is de klinisch moleculair bioloog in de pathologie niet verantwoordelijk voor de diagnose op weefsel en cytologisch materiaal en de rapportage daarvan aan de behandelend arts. Die verantwoordelijkheid ligt bij de patholoog en de verantwoordelijkheid voor de op die diagnose berustende behandeling van de patiënt ligt vervolgens bij de behandelend arts die de rapportage van de patholoog heeft ontvangen en er zijn behandeling op baseert.
2.3 Het advies moet daarom negatief zijn.
Uit voorwoord blijkt dat programma is samengesteld door wetenschappelijke committee
CGR 8 mei 2015, LS&R 1146; AA15.036 (Bijeenkomst in Rome) Blijkens het voorwoord van de hand van topbestuurder van X is het programma samengesteld door de International Scientific Committee, van 4 van de 8 een een c.v. overgelegd waar een hoge wetenschappelijke status blijkt. Enige betrokkenheid van de sprekers/inleiders bij de farmaceutische industrie volgt niet, maar van een aantal (de minderheid) is geen c.v. overlegd; de Codecommissie gaat er van uit dat ook deze sprekers geen band hebben. X wordt in overweging gegeven bij een volgende aanvraag een disclosure-slide te overleggen.
Blijkens het voorwoord van de hand van topbestuurder van X is het programma samengesteld door de International Scientific Committee, van 4 van de 8 een een c.v. overgelegd waar een hoge wetenschappelijke status blijkt. Enige betrokkenheid van de sprekers/inleiders bij de farmaceutische industrie volgt niet, maar van een aantal (de minderheid) is geen c.v. overlegd; de Codecommissie gaat er van uit dat ook deze sprekers geen band hebben. X wordt in overweging gegeven bij een volgende aanvraag een disclosure-slide te overleggen.
2.8. Uit de overgelegde c.v.’s blijkt niet van enige betrokkenheid van de desbetreffende sprekers/inleiders bij de farmaceutische industrie. Van een aantal sprekers/inleiders (de minderheid) is geen c.v. overgelegd. De Codecommissie gaat er van uit, dat ook deze sprekers geen banden hebben met de farmaceutische industrie. Mocht dat toch het geval zijn dan verwacht de Codecommissie dat deze spreker(s)/inleider(s) die banden vóór aanvang van de bijeenkomst bekend zal/zullen maken. [X] wordt in overweging gegeven bij een volgende aanvraag een disclosure-slide (zie VII.1.2.) over te leggen.
2.9. Blijkens het voorwoord bij het programma van de hand van de topbestuurder van [X] is het programma samengesteld door de International Scientific Committee. Van 4 van de 8 leden van dit Committee zijn c.v.’s overgelegd. De Codecommissie heeft via internet de (gepubliceerde) c.v.’s van de andere 4 leden geraadpleegd en daaruit blijkt een hoge wetenschappelijke status van de 4. De Codecommissie gaat er gelet op de status van de Committee-leden van uit dat hoewel genoemde topbestuurder als Chairman van (ook) de Committee staat vermeld, het de 8 leden van de Committee zijn geweest die het programma hebben samengesteld. De Codecommissie gaat er verder van uit dat het aldus samengestelde programma voorziet in een onafhankelijke informatiebehoefte van beroepsbeoefenaren.
Zwaarwegende grond voor opzegging huisartsenaansluitovereenkomst
Vzr. Rechtbank Oost-Brabant 13 juli 2015, LS&R 1145; ECLI:NL:RBOBR:2015:4426 (eiser tegen Coöperatieve huisartsendienst Noord-Brabant Noordoost) Duurovereenkomst. Opzegging aansluitovereenkomst tussen huisarts en coöperatieve huisartsendienst, door coöperatieve huisartsendienst. In verband met de aard van de overeenkomst, het belang van de patiënten van de huisarts om in spoedeisende gevallen zich tot een huisartsenpost te kunnen wenden en de omstandigheid dat de huisarts zowel praktisch als financieel wordt benadeeld bij beëindiging van de overeenkomst, dient een voldoende zwaarwegende grond voor opzegging te bestaan.
Duurovereenkomst. Opzegging aansluitovereenkomst tussen huisarts en coöperatieve huisartsendienst, door coöperatieve huisartsendienst. In verband met de aard van de overeenkomst, het belang van de patiënten van de huisarts om in spoedeisende gevallen zich tot een huisartsenpost te kunnen wenden en de omstandigheid dat de huisarts zowel praktisch als financieel wordt benadeeld bij beëindiging van de overeenkomst, dient een voldoende zwaarwegende grond voor opzegging te bestaan.
Coöperatieve huisartsendienst heeft (mede) op basis van het advies van de Landelijke Commissie van Advies op goede grond besloten dat er zodanige twijfel was over het functioneren van de huisarts als postarts dat een zwaarwegende grond voor opzegging van de aansluitovereenksomt bestond. Het belang van een kwalitatief goede gezondheidszorg en het belang dat de coöperatieve huisartsendienst heeft dat de huisartsen die op haar posten werken verantwoorde en veilige zorg verlenen en in collegiaal verband hun werkzaamheden uitvoeren dient te prevaleren boven het belang van de huisarts bij uitoefening van zijn werkzaamheden als postarts.
Niet meer bijdragen dan deelnemersbedrag
CGR 13 april 2015, LS&R 1144; AA15.035 (Niet meer dan strikt noodzakelijkl) In Brussel zal een congres plaatsvinden, voor het congres is accreditatie aangevraagd; de kosten wegens gastvrijheid bij deelname bedragen €480, verzoekster heeft het voornemen per deelnemer €500 te vergoeden. Er wordt niet voldaan aan alle vereisten voor gastvrijheid; de bijdrage zal terug moeten worden gebracht tot €480 en er moet bewijs worden verstrekt van verleende accreditatie van de wetenschappelijke vereniging.
In Brussel zal een congres plaatsvinden, voor het congres is accreditatie aangevraagd; de kosten wegens gastvrijheid bij deelname bedragen €480, verzoekster heeft het voornemen per deelnemer €500 te vergoeden. Er wordt niet voldaan aan alle vereisten voor gastvrijheid; de bijdrage zal terug moeten worden gebracht tot €480 en er moet bewijs worden verstrekt van verleende accreditatie van de wetenschappelijke vereniging.
De kosten wegens gastvrijheid bij deelname aan het congres bedragen per deelnemer € 480,--. Verzoekster heeft het voornemen per deelnemer een bedrag van € 500,-- te vergoeden.
De gastvrijheid blijft bij een bijeenkomst binnen redelijke perken wanneer de voor rekening van de vergunninghouder komende kosten van gastvrijheid per beroepsbeoefenaar en per therapeutische klasse niet meer bedragen dan strikt noodzakelijk en in ieder geval niet meer dan € 500,00 per keer en € 1.500,00 per jaar waarbij voor het maximum ook de bedragen die reeds ontvangen zijn voor andere bijeenkomsten georganiseerd door derden voor dezelfde therapeutische klasse worden meegeteld. Aan dit vereiste is niet voldaan, nu niet gezegd kan worden dat de kosten wegens gastvrijheid tot het strikt noodzakelijke zijn beperkt.Een en ander brengt mee dat nog niet aan alle vereisten is voldaan. De Codecommissie komt op grond van een en ander tot de conclusie dat op twee punten nadere actie van verzoekster moet worden gevraagd. Zij zal haar bijdrage terug moeten brengen tot het bedrag van € 480,-- en zo spoedig mogelijk bewijs moeten verstrekken van verleende accreditatie. Indien aan deze vereisten wordt voldaan, kan van een positief advies worden uitgegaan. Mocht verzoekster daaraan niet voldoen, dan zal de Codecommissie negatief moeten adviseren.
Internetconsultatie Besluit uitvoering Tabakswet en bijlage
Concept regeling wijziging van het Besluit uitvoering Tabakswet en de bijlage bij de Tabakswet i.v.m. Rl. 2014/40/EU - Concept nota van toelichting Op 26 februari 2014 heeft het Europees Parlement ingestemd met de nieuwe Tabaksproductenrichtlijn. Deze richtlijn beoogt het beter functioneren van de interne markt voor tabaksproducten en aanverwante producten, met als uitgangspunt een hoog niveau van bescherming van de volksgezondheid. Nederland is verplicht om de voorschriften uit de richtlijn uiterlijk 20 mei 2016 in te voeren. Met deze consultatieprocedure worden de belangrijkste keuzes die voortvloeien uit de richtlijn voorgelegd.
Op 26 februari 2014 heeft het Europees Parlement ingestemd met de nieuwe Tabaksproductenrichtlijn. Deze richtlijn beoogt het beter functioneren van de interne markt voor tabaksproducten en aanverwante producten, met als uitgangspunt een hoog niveau van bescherming van de volksgezondheid. Nederland is verplicht om de voorschriften uit de richtlijn uiterlijk 20 mei 2016 in te voeren. Met deze consultatieprocedure worden de belangrijkste keuzes die voortvloeien uit de richtlijn voorgelegd.
Vraag aan HvJ: Is nationaal verbod voor voedingssupplement met aminozuren in strijd met levensmiddelenwetgeving?
Prejudiciële vragen gesteld aan HvJ EU 27 mei 2015, LS&R 1142; C-282/15 (Queisser Pharma) Verzoekster is een in DUI gevestigde onderneming die onder meer voedingssupplementen produceert. Eén daarvan bevat het aminozuur L-histidine. Voor dit supplement is voor vervaardiging en in de handel brengen een ontheffing nodig. Zij vraagt deze op 27-03-2006 aan bij verweerder (Bundesamt für Verbraucherschutz und Lebensmittelsicherheit) met vermelding dat naar haar idee geen ontheffingsaanvraag nodig zou zijn omdat het gebruik van L-histidine geen enkel gevaar voor de gezondheid oplevert, maar dat zij de aanvraag indient op verzoek van de inspectie. Bij beschikking van 02-11-2012 wordt haar verzoek afgewezen. Verzoekster zou niet aan alle voorwaarden voldoen: er bestaat volgens verweerder wel een gezondheidsrisico. Verzoekster maakt op 07-12-2012 bezwaar (met bewijsstukken dat het ingenomen ijzer veilig is voor de gezondheid), maar dat wordt 20-02-2013 afgewezen. Verzoekster gaat dan in beroep bij de verwijzende rechter. Zij vraagt een verklaring voor recht dat geen ontheffing nodig is en dat het stellen van een dergelijke eis in strijd is met EURrecht. Vo. 178/2002 betreft een uitputtende regeling, (afwijking niet toegestaan) en er is in casu geen sprake van aangetoonde onveiligheid van levensmiddelen. Verweerder verwijst ook naar RL 2002/46 en stelt dat de DUI regeling in het leven is geroepen omdat niet was aangetoond dat toevoeging van aminozuren aan levensmiddelen geen gevaar voor de volksgezondheid oplevert. Maar zij verleent verzoekster op 17-02-2015 alsnog een ontheffing voor drie jaar.
Verzoekster is een in DUI gevestigde onderneming die onder meer voedingssupplementen produceert. Eén daarvan bevat het aminozuur L-histidine. Voor dit supplement is voor vervaardiging en in de handel brengen een ontheffing nodig. Zij vraagt deze op 27-03-2006 aan bij verweerder (Bundesamt für Verbraucherschutz und Lebensmittelsicherheit) met vermelding dat naar haar idee geen ontheffingsaanvraag nodig zou zijn omdat het gebruik van L-histidine geen enkel gevaar voor de gezondheid oplevert, maar dat zij de aanvraag indient op verzoek van de inspectie. Bij beschikking van 02-11-2012 wordt haar verzoek afgewezen. Verzoekster zou niet aan alle voorwaarden voldoen: er bestaat volgens verweerder wel een gezondheidsrisico. Verzoekster maakt op 07-12-2012 bezwaar (met bewijsstukken dat het ingenomen ijzer veilig is voor de gezondheid), maar dat wordt 20-02-2013 afgewezen. Verzoekster gaat dan in beroep bij de verwijzende rechter. Zij vraagt een verklaring voor recht dat geen ontheffing nodig is en dat het stellen van een dergelijke eis in strijd is met EURrecht. Vo. 178/2002 betreft een uitputtende regeling, (afwijking niet toegestaan) en er is in casu geen sprake van aangetoonde onveiligheid van levensmiddelen. Verweerder verwijst ook naar RL 2002/46 en stelt dat de DUI regeling in het leven is geroepen omdat niet was aangetoond dat toevoeging van aminozuren aan levensmiddelen geen gevaar voor de volksgezondheid oplevert. Maar zij verleent verzoekster op 17-02-2015 alsnog een ontheffing voor drie jaar.
De verwijzende DUI rechter (Verwaltungsgericht Braunschweig) moet beslist worden over het verzoek om een declaratoire uitspraak, waarvoor hij verduidelijking nodig heeft van het HvJEU. Uit de DUI regelgeving is duidelijk dat de gelijkstelling van het aminozuur L-histidine met levenmiddelenadditieven het verkrijgen van een ontheffing noodzakelijk maakt. Vervolgens moet verweerder bezien of is voldaan aan de voorwaarden voor ontheffing. De verwijzende rechter twijfelt of de daartoe gestelde eisen in overeenstemming met EURrecht zijn. Hij legt de volgende vragen voor aan het HvJEU:
1. Moeten de artikelen 34, 35 en 36 van het Verdrag betreffende de werking van de Europese Unie, gelezen in samenhang met artikel 14 van verordening (EG) nr. 178/2002 van het Europees Parlement en de Raad van 28 januari 2002 tot vaststelling van de algemene beginselen en voorschriften van de levensmiddelenwetgeving, tot oprichting van een Europese Autoriteit voor voedselveiligheid en tot vaststelling van procedures voor voedselveiligheidsaangelegenheden, aldus worden uitgelegd dat zij zich verzetten tegen een nationale wettelijke regeling waarbij de vervaardiging of verwerking respectievelijk het in de handel brengen van een voedingssupplement met aminozuren (in dit geval L-histidine) wordt verboden voor zover daarvoor niet onder bepaalde nadere voorwaarden een tijdelijke ontheffing is verleend door de bevoegde nationale autoriteit, die ter zake over een discretionaire bevoegdheid beschikt?
2. Volgt uit de opzet van de artikelen 14, 6, 7, 53 en 55 van verordening (EG) nr. 178/2002 van het Europees Parlement en de Raad van 28 januari 2002 tot vaststelling van de algemene beginselen en voorschriften van de levensmiddelenwetgeving, tot oprichting van een Europese Autoriteit voor voedselveiligheid en tot vaststelling van procedures voor voedselveiligheidsaangelegenheden, dat een nationaal verbod op een bepaald levensmiddel of voedselingrediënt alleen onder de aldaar genoemde voorwaarden kan worden ingesteld, en verzet die opzet zich tegen een nationale wettelijke regeling als bedoeld in de eerste vraag?
3. Moet artikel 8 van verordening (EG) nr. 1925/2006 van het Europees Parlement en de Raad van 20 december 2006 betreffende de toevoeging van vitaminen en mineralen en bepaalde andere stoffen aan levensmiddelen aldus worden uitgelegd dat het in de weg staat aan een nationale wettelijke regeling als bedoeld in de eerste vraag?
Zinkzout valt niet onder beschermingsomvang en dus partieel nietige ABC
Rechtbank Den Haag 15 juli 2015, LS&R 1140; ECLI:NL:RBDHA:2015:8197 (Resolution tegen Shionogi c.s.)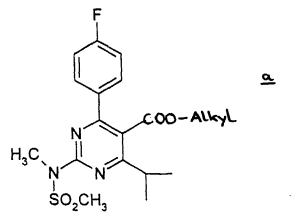
3.2. Aan haar vorderingen legt Resolution ten grondslag - kort gezegd - dat de conclusies 1 en 2 van het Nederlandse deel van EP 471, alsmede de daarvan afhankelijke conclusies, op grond van artikel 75 lid 1 sub c Rijksoctrooiwet 1995 (hierna: ROW) niet verleend hadden mogen worden voor zover deze meer omvatten dan rosuvastatine calcium en/of rosuvastatine natrium vanwege toegevoegde materie, zodat het ABC op grond van artikel 15 lid 1 sub c Verordening EG nr. 469/2009 van het Europees Parlement en de Raad van 6 mei 2009 betreffende het aanvullende beschermingscertificaat voor geneesmiddelen (hierna: beschermingscertificaatVo) partieel nietig is nu na verval van het basisoctrooi nietigheidsgronden bestaan die een beperking gerechtvaardigd zouden hebben. Voorts legt Resolution aan haar vorderingen ten grondslag dat zij met de voorgenomen verhandeling van rosuvastatine zink in Nederland - ook indien het ABC (geheel) geldig wordt geacht - geen inbreuk zal maken op het ABC.
4.19 (...) De vakman mag aannemen dat de keuze voor de in paragraaf [0007] geopenbaarde zouten een bewuste keuze is geweest van de octrooihouder, bijvoorbeeld vanwege de uitkomsten van een zoutenonderzoek, en dat de octrooihouder in zoverre dus afstand heeft gedaan van andere zouten die mogelijk zouden kunnen worden toegepast. Andere zouten zal hij om deze reden dan ook niet aanmerken als (geschikte) equivalenten die onder de beschermingsomvang van de geclaimde uitvinding vallen, ook al ziet hij in dat het rosuvastatine-anion uiteindelijk verantwoordelijk is voor het blokkeren van de HMG-CoA reductase.
slotsom
4.34. Uit het vorenstaande volgt dat rosuvastatine-zinkzout niet onder conclusie 1 van EP 471 en de daarvan afhankelijke conclusies kan worden geacht te hebben gevallen. Ingevolge artikel 4 BeschermingscertificaatVo geldt dit derhalve ook voor het op grond van het basisoctrooi verleende ABC. Van (dreigende) inbreuk op het ABC is dan ook geen sprake.
De rechtbank
5.1. verklaart nietig het beschermingscertificaat met nummer 300125 voor zover de bescherming ervan zich uitstrekt over andere producten dan de in paragraaf [0007] van EP 471 genoemde niet-toxische farmaceutisch aanvaardbare zouten van rosuvastatine, te weten die waarin het kation bestaat uit een alkalimetaalion, een aardalkalimetaalion of een ammoniumion;
5.2. verklaart voor recht dat Resolution (en/of haar klanten) geen inbreuk maakt/maken op de rechten van Shionogi onder beschermingscertificaat met nummer 300125 door rosuvastatine zink in Nederland te vervaardigen, te gebruiken, in het verkeer te brengen of (verder) te verkopen, te verhuren, af te leveren of anderszins te verhandelen, dan wel voor een of ander aan te bieden, in te voeren of in voorraad te hebben;
Op andere blogs:
SPC blog
Bewijsopdracht: artsenverklaring en de apothekersinstructie slechts een administratieve weerslag van het CFH-rapport
Hof Den Haag 3 maart 2015; LS&R 1139 ; ECLI:NL:GHDHA:2015:342 (Apotheek Ridderveld c.s. tegen Achmea c.s.) Zorgverzekeringswet. Contract tussen zorgverzekeraar en apotheek voor de vergoeding aan de apotheek van farmaceutische zorg voor de verzekerden van de zorgverzekeraar. De vraag is of de voorwaarden die de zorgverzekeraar stelt aan de vergoeding van het geneesmiddel infliximab stroken met de voorwaarden voor verstrekking zoals die zijn neergelegd in Bijlage 2 bij de Regeling Zorgverzekering en de rapporten over infliximab van de Commissie Farmaceutische Hulp. Tussenarrest. Bewijsopdracht aan zorgverzekeraar.
Zorgverzekeringswet. Contract tussen zorgverzekeraar en apotheek voor de vergoeding aan de apotheek van farmaceutische zorg voor de verzekerden van de zorgverzekeraar. De vraag is of de voorwaarden die de zorgverzekeraar stelt aan de vergoeding van het geneesmiddel infliximab stroken met de voorwaarden voor verstrekking zoals die zijn neergelegd in Bijlage 2 bij de Regeling Zorgverzekering en de rapporten over infliximab van de Commissie Farmaceutische Hulp. Tussenarrest. Bewijsopdracht aan zorgverzekeraar.
3.15 Gezien het vorenstaande, ligt het naar het oordeel van het hof op de weg van Achmea om haar stelling te bewijzen dat de artsenverklaring en de apothekersinstructie slechts een administratieve weerslag vormen van het rapport van de CFH en dat (dus) in de jaren 2008-2010 slechts van therapieresistente hidradenitis suppurativa kon worden gesproken indien naast behandeling met een antibioticum, ook een systemische immunosuppressieve therapie is toegepast. Het is immers Achmea die – ter onderbouwing van haar op onverschuldigde betaling gebaseerde vordering – zich erop beroept dat de desbetreffende verzekerden geen aanspraak hadden op verstrekking van infliximab, zodat stelplicht en bewijslast op haar rusten.
Het komt het hof voor dat dit bewijs op verschillende manieren geleverd zou kunnen worden, waaronder bewijs door een onafhankelijk deskundige. Het hof zal Achmea in de gelegenheid stellen zich bij akte uit te laten over de wijze waarop zij het bewijs wenst te leveren, waarna Apotheek Ridderveld c.s. bij antwoordakte kunnen reageren. Indien Achmea de voorkeur geeft aan de benoeming van een deskundige door het hof, wordt zij verzocht met Apotheek Ridderveld c.s. in overleg te treden over de persoon van de deskundige, alsmede over de aan deze te stellen vragen.
3.23. Naar het oordeel van het hof is deze verklaring onvoldoende. Hoewel blijkt dat sprake is van ernstige sarcoïdose, de toegepaste immunosuppressieve therapie kennelijk niet (voldoende) aansloeg en verzekerde veel bijwerkingen had, is onvoldoende duidelijk gemaakt waarom geen andere immunosuppressieve therapie is geprobeerd en direct is gekozen voor behandeling met infliximab. Daarmee staat vast dat aan de verzekerde met polisnummer (…)752 op grond van de toepasselijke regelgeving geen aanspraak kon maken op vergoeding van de aan hem verstrekte infliximab. Partijen wordt verzocht in de hiervoor bedoelde akte het hof nader te informeren welk bedrag is gedeclareerd voor de verstrekking van infliximab aan deze verzekerde.
9.2 Ter zake van de overige verzekerden geldt het volgende. Zoals overwogen in r.o 3.15 zal Achmea worden toegelaten tot het bewijs dat de artsenverklaring en de apothekersinstructie slechts een administratieve weerslag vormen van het rapport van de CFH en dat (dus) in de jaren 2008-2010 slechts van therapieresistente hidradenitis suppurativa kon worden gesproken indien naast behandeling met een antibioticum, ook een systematische immunosuppressieve therapie is toegepast. Achmea zal zich bij akte kunnen uitlaten over de vraag op welke wijze zij dit bewijs wenst te leveren. In zoverre wordt het oordeel over grief 5 aangehouden.

















