Geen afgifte medisch dossier vanwege ontbreken zwaarwegend belang
Hof 's-Hertogenbosch 6 oktober 2015, LS&R 1191; ECLI:NL:GHSHE:2015:3901 (appellante tegen Stichting Volckaert) Vordering afgifte medisch dossier na overlijden. De geheimhoudingsplicht waaraan Volckaert gebonden is, geldt onverkort na de dood van de patient. Niettemin komt aan de nabestaanden een recht op inzage toe, indien er concrete aanwijzingen bestaan dat een ander zwaarwegend belang geschaad zou kunnen worden. Vervolgens moet worden beoordeeld of er voldoende concrete aanwijzingen zijn dat de moeder wilsonbekwaam was. Vergeetachtigheid is niet op een lijn te stellen met wilsonbekwaamheid. Daarnaast zijn er geen concrete aanwijzingen voor een ander zwaarwegend belang. De algemene stelling dat appellante geïnformeerd wil worden over de aanwezigheid van erfelijke componenten/ziekten, is in strijd met de belangen die met geheimhouding zijn gediend. Ook de stelling dat appellante grote emotionele problemen heeft gehad met het ziektebeeld en hoe er met haar moeder is omgegaan, is niet te beschouwen als een zwaarwegend belang. Het hof bekrachtigt het vonnis van de voorzieningenrechter.
Vordering afgifte medisch dossier na overlijden. De geheimhoudingsplicht waaraan Volckaert gebonden is, geldt onverkort na de dood van de patient. Niettemin komt aan de nabestaanden een recht op inzage toe, indien er concrete aanwijzingen bestaan dat een ander zwaarwegend belang geschaad zou kunnen worden. Vervolgens moet worden beoordeeld of er voldoende concrete aanwijzingen zijn dat de moeder wilsonbekwaam was. Vergeetachtigheid is niet op een lijn te stellen met wilsonbekwaamheid. Daarnaast zijn er geen concrete aanwijzingen voor een ander zwaarwegend belang. De algemene stelling dat appellante geïnformeerd wil worden over de aanwezigheid van erfelijke componenten/ziekten, is in strijd met de belangen die met geheimhouding zijn gediend. Ook de stelling dat appellante grote emotionele problemen heeft gehad met het ziektebeeld en hoe er met haar moeder is omgegaan, is niet te beschouwen als een zwaarwegend belang. Het hof bekrachtigt het vonnis van de voorzieningenrechter.
6.7. In kort geding dient beoordeeld te worden of het waarschijnlijk is dat de bodemrechter een vordering tot afgifte van het medisch en zorgdossier zal toewijzen.
Het hof stelt in dat kader het volgende voorop. De geheimhoudingsplicht (neergelegd in art 7:457 BW), waaraan ook Volckaert gebonden is, geldt onverkort na de dood van de patiënt. Niettemin komt aan nabestaanden een recht op inzage toe, indien er concrete aanwijzingen bestaan dat een ander zwaarwegend belang geschaad zou kunnen worden (zie HR 20 april 2001, ECLI:NL:HR:2001:AB1201). De partij die afgifte of inzage vordert dient derhalve het bestaan van dergelijke concrete aanwijzingen aannemelijk te maken.
Grief 1, die zich in de kern richt tegen de overweging van de voorzieningenrechter dat [appellante] dergelijke concrete aanwijzingen aannemelijk moet maken, faalt derhalve.
6.8. Vervolgens moet beoordeeld worden of er voldoende concrete aanwijzingen zijn voor de stelling dat de moeder van [appellante] wilsonbekwaam was ten tijde van het verlijden van het testament op 23 november 2007. Dat moeder op 19 april 2010 (bijna tweeëneenhalf jaar later) is opgenomen op de gesloten afdeling van Volckaert acht het hof, mede gelet op het tijdsverloop, voorshands geen concrete aanwijzing voor de stelling dat zij op 23 november 2007 niet in staat was haar wil te bepalen. Hetzelfde geldt voor de algemene stellingen van [appellante] dat haar moeder ook voor de opname naar dagbehandeling werd gebracht en gehaald, dat sprake was van ambulante behandeling en dat er jaren voor de opname is gesproken over vergeetachtigheid van moeder en een eerder geriatrisch onderzoek zou hebben plaatsgevonden. Daarbij betrekt het hof dat vergeetachtigheid geenszins op een lijn te stellen is met (een vermoeden van) wilsonbekwaamheid en dat het enkele feit dat een geriatrisch onderzoek heeft plaatsgevonden, zonder nadere toelichting, evenmin een concrete aanwijzing van wilsonbekwaamheid vormt.
Nu al deze omstandigheden, ook in onderling verband bezien, onvoldoende concrete aanwijzingen vormen voor de stelling dat haar moeder op 23 november 2007 wilsonbekwaam was, wordt de vordering van [appellante] , voor zover gegrond op dit belang (het aanvechten van de rechtsgeldigheid van het testament), afgewezen.
HvJ EU: Datum kennisbrenging vergunningsbesluit aan adressaat is eerste vergunning
HvJ EU 6 oktober 2015, LS&R 1190; C-471/14; ECLI:EU:C:2015:659 (Seattle Genetics )ABC voor medische producten. Het hof verklaart voor recht:
1) Artikel 13, lid 1, van verordening (EG) nr. 469/2009 van het Europees Parlement en de Raad van 6 mei 2009 betreffende het aanvullende beschermingscertificaat voor geneesmiddelen moet aldus worden uitgelegd dat het begrip „datum van de eerste vergunning voor het in de handel brengen in de [Europese Unie]” wordt bepaald door het Unierecht.
2) Artikel 13, lid 1, van verordening nr. 469/2009 moet aldus worden uitgelegd dat de „datum van de eerste vergunning voor het in de handel brengen in de [Unie]” in de zin van die bepaling de datum is waarop van het besluit tot verlening van een vergunning voor het in de handel brengen, ter kennis is gebracht aan de adressaat ervan.
Gestelde vragen:
1) Wordt de datum van de eerste [VHB] in de [Unie] als bedoeld in artikel 13, lid 1, van verordening nr. 469/2009 door het [Unie]recht bepaald of verwijst deze bepaling naar de datum waarop de vergunning volgens het recht van de betrokken lidstaat van kracht wordt?
2) Indien het Hof van Justitie van de Europese Unie voor recht verklaart dat de in de eerste vraag bedoelde datum door het [Unie]recht wordt bepaald, welke datum moet dan in aanmerking worden genomen: die waarop de vergunning is afgegeven of die waarop de kennisgeving heeft plaatsgevonden?
HvJ EU: Een wijziging van een adres houdt niet in dat de vergunninghouder alle vergoedingen moet voldoen van vergunningen die gewijzigd moeten worden
HvJ EU 1 oktober 2015, zaak C-452/14 (Agenzia Italiana del Farmaco tegen Doc Generici) Prejudiciële verwijzing. Geneesmiddel voor menselijk gebruik. Het betreft een verzoek om een prejudiciële beslissing krachtens art. 267 VWEU, ingediend door Consiglio dit Stato (Italië) bij beslissing van 22 mei 2014. Het Hof verklaart voor recht: 1) Noch verordening (EG) nr. 297/95 van de Raad van 10 februari 1995 inzake de vergoedingen die aan het Europees Bureau voor de geneesmiddelenbeoordeling dienen te worden betaald, zoals gewijzigd bij verordening (EU) nr. 273/2012 van de Commissie van 27 maart 2012, noch verordening (EG) nr. 1234/2008 van de Commissie van 24 november 2008 betreffende het onderzoek van wijzigingen in de voorwaarden van vergunningen voor het in de handel brengen van geneesmiddelen voor menselijk gebruik en geneesmiddelen voor diergeneeskundig gebruik, zoals gewijzigd bij verordening (EU) nr. 712/2012 van de Commissie van 3 augustus 2012, legt op of verbiedt dat een bevoegde nationale autoriteit eist dat voor een wijziging van het adres van de houder van een vergunning voor het in de handel brengen, zoveel vergoedingen worden betaald als er vergunningen voor het in de handel brengen moeten worden gewijzigd. 2) Artikel 267 VWEU moet aldus worden uitgelegd dat een rechterlijke instantie waarvan de beslissingen volgens het nationale recht niet vatbaar zijn voor hoger beroep, in omstandigheden als die welke in het hoofdgeding aan de orde zijn, gehouden is gevolg te geven aan haar verwijzingsverplichting.
Prejudiciële verwijzing. Geneesmiddel voor menselijk gebruik. Het betreft een verzoek om een prejudiciële beslissing krachtens art. 267 VWEU, ingediend door Consiglio dit Stato (Italië) bij beslissing van 22 mei 2014. Het Hof verklaart voor recht: 1) Noch verordening (EG) nr. 297/95 van de Raad van 10 februari 1995 inzake de vergoedingen die aan het Europees Bureau voor de geneesmiddelenbeoordeling dienen te worden betaald, zoals gewijzigd bij verordening (EU) nr. 273/2012 van de Commissie van 27 maart 2012, noch verordening (EG) nr. 1234/2008 van de Commissie van 24 november 2008 betreffende het onderzoek van wijzigingen in de voorwaarden van vergunningen voor het in de handel brengen van geneesmiddelen voor menselijk gebruik en geneesmiddelen voor diergeneeskundig gebruik, zoals gewijzigd bij verordening (EU) nr. 712/2012 van de Commissie van 3 augustus 2012, legt op of verbiedt dat een bevoegde nationale autoriteit eist dat voor een wijziging van het adres van de houder van een vergunning voor het in de handel brengen, zoveel vergoedingen worden betaald als er vergunningen voor het in de handel brengen moeten worden gewijzigd. 2) Artikel 267 VWEU moet aldus worden uitgelegd dat een rechterlijke instantie waarvan de beslissingen volgens het nationale recht niet vatbaar zijn voor hoger beroep, in omstandigheden als die welke in het hoofdgeding aan de orde zijn, gehouden is gevolg te geven aan haar verwijzingsverplichting.
Prejudiciële vragen die gesteld zijn:
Moet artikel 3, lid 2, sub a, van de thans geldende versie van verordening (EG) nr. 297/95 van de Raad van 10 februari 19951 aldus worden uitgelegd dat voor wijzigingen van vergunningen voor het in de handel brengen van type I ‒ in het bijzonder, wat het hoofdgeding betreft, van type I A ‒ in geval van identieke wijzigingen die betrekking hebben op meerdere vergunningen voor het in de handel brengen die toebehoren aan dezelfde vergunninghouder, een enkele vergoeding moet worden betaald, in de daarin bepaalde omvang, dan wel aldus dat voor iedere vergunning waarop de wijziging betrekking heeft een vergoeding moet worden betaald?
Mag dan wel ‒ zoals de verwijzende rechter van oordeel is ‒ moet in omstandigheden als die van de onderhavige zaak de vraag aan het Hof van Justitie worden voorgelegd?
Meewerken aan geneeskundige behandelingsovereenkomst door zorginstelling verplicht
Vzr. Rechtbank Zeeland-West-Brabant 15 april 2015, LS&R 1188; ELCI:NL:RBZWB:2015:2681 (eisers tegen Stichting WVO Zorg) Geneeskundige behandelingsovereenkomst. Eiseres is getroffen door een hersenbloeding waarvan zij ernstige medische beperkingen ondervindt waarna opname in een verpleeghuis heeft plaatsgevonden. Eiseres heeft een euthanasieverzoek gedaan. Dit verzoek mag niet worden uitgevoerd in de verpleeginstelling. Om die reden wil de verpleeginstelling de zorgovereenkomst beëindigen. Rechtbank bepaalt dat gedaagde moet meewerken aan de beëindiging van de geneeskundige behandelingsovereenkomst dan wel zorgleveringsovereenkomst die is gesloten tussen eiseres en gedaagde.
Geneeskundige behandelingsovereenkomst. Eiseres is getroffen door een hersenbloeding waarvan zij ernstige medische beperkingen ondervindt waarna opname in een verpleeghuis heeft plaatsgevonden. Eiseres heeft een euthanasieverzoek gedaan. Dit verzoek mag niet worden uitgevoerd in de verpleeginstelling. Om die reden wil de verpleeginstelling de zorgovereenkomst beëindigen. Rechtbank bepaalt dat gedaagde moet meewerken aan de beëindiging van de geneeskundige behandelingsovereenkomst dan wel zorgleveringsovereenkomst die is gesloten tussen eiseres en gedaagde.
4.1. Ter beoordeling staat eerst de vraag of [eiseres sub 1] wilsbekwaam is de zorgovereenkomst op te zeggen en aldus zelf zal kunnen beslissen te vertrekken bij WVO. Bij deze beoordeling moet worden betrokken dat de opzegging van de zorgovereenkomst niet op zichzelf staat; de opzegging door [eiseres sub 1] is erop gericht om kort na haar vertrek bij WVO door de SLK te worden geholpen bij haar levenseinde.
4.6. Op grond van al het vorenstaande is de voorzieningenrechter van oordeel dat van de wilsbekwaamheid van [eiseres sub 1] ten aanzien van haar euthanasiewens voldoende is gebleken. Hieruit volgt ook dat er vanuit mag worden gegaan dat zij de gevolgen van de opzegging van de zorgovereenkomst voldoende overziet en derhalve wilsbekwaam moet worden geacht deze op te zeggen. De vordering zal dan ook worden toegewezen.De voorzieningenrechter:
5.1. veroordeelt WVO op een door [eisers] te bepalen datum die is gelegen in april 2015 mee te werken aan de beëindiging van de geneeskundige behandelingsovereenkomst dan wel zorgleveringsovereenkomst die is gesloten tussen [eiseres sub 1] en WVO (...)
Onvoldoende onderbouwing door Bihol dat Qualiphar contractproducten heeft geleverd
Hof Arnhem-Leeuwarden 4 augustus 2015, LS&R 1187; ECLI:NL:GHARL:2015:5860 (Bihol tegen Qualiphar)
 Merkenrecht. Bihol en Qualiphar zijn ondernemingen die zich bezighouden met de ontwikkeling, productie en verkoop van voorschriftvrije geneesmiddelen en gezondheidsmiddelen. Bihol heeft aan haar vorderingen bij de rechtbank ten grondslag gelegd dat Qualiphar in strijd met de overeenkomst producten met de merken BIOROPA en OSTRIN buiten de Benelux heeft aangeboden en de merken in Frankrijk, Turkijke en Cyprus heeft laten registreren. De rechtbank heeft de vorderingen afgewezen. Hiertegen is Bihol zonder succes in beroep gekomen. Het hof oordeelt dat Qualiphar niet aansprakelijk kan worden gehouden voor de wederverkoop van haar contractproducten door haar afnemers buiten de Benelux en dus ook niet voor de verkoop van haar contractproducten door haar afnemers op het internet. Daarnaast zijn Qualiphar en Gifrer afzonderlijke vennootschappen en kan niet worden aangetoond dat Gifrer contractproducten van Qualiphar verkoopt of dat Qualiphar producten op haar website verkoopt. De grieven falen.
Merkenrecht. Bihol en Qualiphar zijn ondernemingen die zich bezighouden met de ontwikkeling, productie en verkoop van voorschriftvrije geneesmiddelen en gezondheidsmiddelen. Bihol heeft aan haar vorderingen bij de rechtbank ten grondslag gelegd dat Qualiphar in strijd met de overeenkomst producten met de merken BIOROPA en OSTRIN buiten de Benelux heeft aangeboden en de merken in Frankrijk, Turkijke en Cyprus heeft laten registreren. De rechtbank heeft de vorderingen afgewezen. Hiertegen is Bihol zonder succes in beroep gekomen. Het hof oordeelt dat Qualiphar niet aansprakelijk kan worden gehouden voor de wederverkoop van haar contractproducten door haar afnemers buiten de Benelux en dus ook niet voor de verkoop van haar contractproducten door haar afnemers op het internet. Daarnaast zijn Qualiphar en Gifrer afzonderlijke vennootschappen en kan niet worden aangetoond dat Gifrer contractproducten van Qualiphar verkoopt of dat Qualiphar producten op haar website verkoopt. De grieven falen.
3.11. Het hof overweegt hierover als volgt. Uit de in redelijkheid niet mis te verstane bewoordingen van artikel 1 sub b van de overeenkomst volgt naar het oordeel van het hof dat alleen de verkoop van contractenproducten door Qualiphar buiten de Benelux is verboden. De considerans noch artikel 1 sub b van de overeenkomst biedt steun voor de stelling van Bihol dat het verbod in artikel 1 sub b van de overeenkomst ook geldt voor de afnemers van Qualiphar en dat Qualiphar op grond van de overeenkomst was gehouden haar afnemers in de Benelux beperkingen op te leggen ter zake de verdere verkoop van die rechtmatig in het verkeer gebrachte producten buiten de Benelux, zoals Bihol in haar memorie van grieven ingang wenst te doen vinden. Steun voor die stelling is evenmin te vinden in artikel 8 van de overeenkomst. In artikel 8 is overeengekomen dat Bihol zich binnen de Benelux van elke mededinging in verband met de producten dient te houden. Zonder nadere toelichting, die ontbreekt, valt niet in te zien dat dit - voor de verkoper van een activiteit doorgaans niet ongebruikelijke - concurrentiebeding op gelijke wijze dient te gelden voor Qualiphar, de koper van die activiteit. Door Bihol zijn geen feiten of omstandigheden aangedragen die erop duiden dat partijen, ondanks ontbrekende bewoordingen in de overeenkomst, desalniettemin de bedoeling hadden ook de verkoop van de contractproducten door de afnemers van Qualiphar buiten de Benelux te beperken. Op grond van de overeenkomst kan Qualiphar dus niet aansprakelijk worden gehouden voor de wederverkoop van haar contractproducten door haar afnemers buiten de Benelux, en dus ook niet, zoals door Qualiphar terecht is aangevoerd, voor de verkoop van haar contractproducten door haar afnemers op het internet, waaronder de door Bihol in grief II genoemde webshop van Newpharma.
3.14. Het hof stelt vast dat uit de overgelegde export catalogus niet blijkt dat Qualiphar en Gifrer zijn gefuseerd. Uit de catalogus blijkt, zoals Qualiphar ook stelt, dat het om twee afzonderlijke vennootschappen gaat. Om die reden faalt het betoog van Bihol. Dat de directie van Qualiphar en het management van Gifrer uit dezelfde personen bestaat is onvoldoende om van een fusie te kunnen spreken. Wel is die omstandigheid reden om twijfels te plaatsen bij de stelling van Qualiphar dat sprake is van "geheel onafhankelijk van elkaar opereren". Die twijfel alleen kan Bihol echter niet baten nu zij geen andere juridische grondslag voor haar betoog meer heeft aangevoerd. In dit kader is van belang dat de in de grieven besloten liggende stelling van Bihol dat Qualiphar en Gifrer moeten worden vereenzelvigd, niet behoeft te worden besproken omdat Bihol in haar memorie van repliek in reactie op de memorie van antwoord van Qualiphar heeft opgemerkt dat zij zich niet op vereenzelviging heeft willen beroepen.
3.18. Het hof overweegt hierover als volgt.Tussen partijen is niet in geschil dat OSTRIN Q10 tabletten als contractproducten moeten worden aangemerkt en dat de verkoop en de levering daarvan door Qualiphar aan Gifrer als een schending van het verbod in artikel 1 sub b van de overeenkomst moet worden beschouwd. Voor haar stelling dat Gifrer de producten in Duitsland en de Verenigde Staten heeft verkocht, heeft Bihol geen relevante feiten en omstandigheden gesteld, zodat aan die stelling wordt voorbijgegaan. Voor zover op grond van de perspublicatie op masculine.com al aangenomen zou kunnen worden dat Gifrer OSTRIN Q10 tabletten in Frankrijk zou hebben verkocht, hetgeen door Qualiphar wordt bestreden, dan volgt daaruit nog niet dat die tabletten van Qualiphar afkomstig zijn. De enkele omstandigheid dat de verpakkingen van Gifrer en Qualiphar in belangrijke mate overeenstemmen is daartoe onvoldoende. Verder is van belang dat Bihol niet heeft weersproken dat Gifrer en Qualiphar in hun export catalogus geen contractproducten aanbieden.
3.22. Het hof overweegt hierover als volgt. De door Bihol (in eerste aanleg) overgelegde kopie van de schermafdruk van de website van Qualiphar bevat slechts een opsomming van de producten van Qualiphar, waaronder OSTRIN Q10. Uit de overgelegde schermafdruk van de website blijkt niet dat Qualiphar de tabletten op haar website te koop aanbiedt. Door Bihol zijn geen andere feiten en/of omstandigheden aangevoerd die haar stelling ondersteunen, zodat het hof, mede gelet op de betwisting ervan, aan die stelling voorbijgaat, nog daargelaten dat niet is komen vast te staan dat de website van Qualiphar ook op landen buiten de Benelux was gericht, zoals Bihol stelt en Qualiphar onderbouwd bestrijdt.
3.24. Het laatste geschilpunt (grief IV) stelt de vraag aan de orde of de registratie van het merk OSTRIN door Qualiphar in Cyprus, Frankrijk en Egypte als gebruik daarvan buiten de Benelux dient te worden beschouwd als bedoeld in artikel 1 sub b van de overeenkomst. De rechtbank heeft die vraag bij gebreke van een deugdelijke onderbouwing daarvan door Bihol ontkennend beantwoord. Ook in hoger beroep onderbouwt Bihol haar stelling niet, zodat ook het hof daaraan voorbij zal gegaan. Grief IV faalt eveneens.
3.25. Naar het oordeel van het hof heeft Bihol dus ook in hoger beroep onvoldoende onderbouwd dat Qualiphar contractproducten aan Gifrer heeft geleverd. Aan het algemene bewijsaanbod van Bihol in randnummer 14 van de memorie van grieven gaat het hof voorbij omdat het onvoldoende is gespecificeerd en ook niet ter zake dienend.
Prejudiciële vragen over dieetvoeding voor medisch gebruik
Prejudiciële vragen gesteld aan HvJ EU 31 juli 2015, LS&R 1186; C-445/15 (Nutricia Souvenaid)
 Gezondheidsclaim. Verzoekster heeft beroep ingesteld tegen een besluit van augustus 2014 van VK-MinVWS (verweerder) dat het product ‘Souvenaid’ niet als dieetvoeding mag worden ingedeeld volgens RL 1999/21. Het gaat om een melkdrank met een smaakje en met toevoegingen die volgens verzoekster voldoen aan de behoeften van personen bij wie het beginstadium van de ziekte van Alzheimer is geconstateerd. Het product wordt in NL geproduceerd en naar twaalf (andere) EULS geëxporteerd waar het als dieetvoeding is aangemeld. Indeling als dieetvoeding geeft de fabrikant het recht om bepaalde beweringen over het voedingsmiddel te doen die kunnen helpen het middel een gespecialiseerde medische markt te laten bereiken en wordt ook voordelig geacht in verband met de regels over tarieven en terugbetaling van geneesmiddelen. Verzoekster heeft het product ontwikkeld voor gebruik onder medisch toezicht. Het is in VK alleen op recept verkrijgbaar, maar zoals verweerder stelt ook via verzoeksters website. Het product is in klinische proeven getest en veilig bevonden.
Gezondheidsclaim. Verzoekster heeft beroep ingesteld tegen een besluit van augustus 2014 van VK-MinVWS (verweerder) dat het product ‘Souvenaid’ niet als dieetvoeding mag worden ingedeeld volgens RL 1999/21. Het gaat om een melkdrank met een smaakje en met toevoegingen die volgens verzoekster voldoen aan de behoeften van personen bij wie het beginstadium van de ziekte van Alzheimer is geconstateerd. Het product wordt in NL geproduceerd en naar twaalf (andere) EULS geëxporteerd waar het als dieetvoeding is aangemeld. Indeling als dieetvoeding geeft de fabrikant het recht om bepaalde beweringen over het voedingsmiddel te doen die kunnen helpen het middel een gespecialiseerde medische markt te laten bereiken en wordt ook voordelig geacht in verband met de regels over tarieven en terugbetaling van geneesmiddelen. Verzoekster heeft het product ontwikkeld voor gebruik onder medisch toezicht. Het is in VK alleen op recept verkrijgbaar, maar zoals verweerder stelt ook via verzoeksters website. Het product is in klinische proeven getest en veilig bevonden.
Het moet met name het verlies van synapsen tegengaan (de verbindingen tussen neuronen in de hersenen). Verzoekster wijst erop dat het hier om zelfcertificering gaat: fabrikanten moeten zelf beslissen of zij moeten voldoen aan de regels betreffende dieetvoeding en zijn zelf verantwoordelijk voor de indeling van hun product. Zij doet dit met inachtneming van de bepalingen van artikel 3 van RL 1999/21. Toetsing moet dan ook volgens een combinatie van subjectieve en objectieve factoren plaatsvinden. Volgens verweerder heeft verzoekster niet aangetoond dat het product voldoet aan een bijzondere voedingsbehoefte, in zoverre dat daarin niet op andere wijze zou kunnen worden voorzien, bijvoorbeeld door gebruik van voedingssupplementen. Hij stelt dat alleen een objectieve toetsing moet plaatsvinden wat dieetvoeding voor medisch gebruik is. Hij acht zich in zaken van consumentenbescherming en volksgezondheid niet gebonden aan de subjectieve toets van een onderneming.
De verwijzende VK rechter (Administrative Court of High Court of Justice) stelt voorop dat de definitie van ‘dieetvoeding voor medisch gebruik’ een drempelbegrip is waarvan de precieze betekenis van groot belang is voor zowel de bevoegde autoriteiten als de fabrikanten en verkopers. Dit is met name van belang gezien de door verzoekster aangevoerde ‘zelfcertificering’. Hij constateert dat in de EULS de regels verschillend worden toegepast en acht het vanuit het oogpunt van rechtszekerheid en de integriteit van de interne markt wenselijk is dat deze regels door de verscheidene bevoegde autoriteiten met de grootst mogelijke consistentie worden toegepast. Hij stelt het HvJEU de volgende vragen:
1. Teneinde een product te kunnen aanmerken als dieetvoeding voor medisch gebruik als bedoeld in de definitie van artikel 1, lid 2, onder b), van richtlijn 1999/21/EG van de Commissie betreffende dieetvoeding voor medisch gebruik:
a. heeft dan objectief te gelden dat:
i) van alle patiënten die lijden aan de specifieke ziekte, aandoening of andere kwaal voor de diëtische behandeling waarvan het product in de handel wordt gebracht (hierna: „geïndiceerde kwaal”), of
ii) van een subgroep van dergelijke patiënten, het vermogen om gewone voedingsmiddelen, bepaalde nutriënten daarin of bepaalde metabolieten in te nemen, te verteren, te absorberen, te metaboliseren of uit te scheiden beperkt, aangetast of verstoord is, of dat zij andere medisch bepaalde behoeften aan nutriënten hebben die een gevolg zijn van de geïndiceerde kwaal?
b. Of is het, subsidiair, ook voldoende dat de fabrikant het product bestemt voor een „medisch bepaald” gebruik als bedoeld in artikel 1, lid 2, onder b), in de zin dat:
i) de fabrikant het product bestemt voor uitsluitend gebruik onder medisch toezicht van klinisch medici die patiënten met de geïndiceerde kwaal behandelen, en dat
ii) een serieuze toezichthoudende klinisch medicus zich per patiënt naar behoren een klinisch oordeel kan vormen dat het gebruik van dat product een passende vorm van diëtische behandeling is voor bepaalde patiënten die aan de geïndiceerde kwaal lijden, omdat de klinisch medicus redelijkerwijs van mening is dat een dergelijke patiënt speciale voedingsbehoeften heeft die verband houden met de geïndiceerde kwaal?
c. Indien het antwoord op de eerste prejudiciële vraag, onder a), ii, bevestigend luidt,
i) welk aandeel van de patiënten met de geïndiceerde kwaal moet de relevante beperking, aantasting of verstoring of andere medisch bepaalde behoefte aan nutriënten hebben, of is er dienaangaande geen minimum, en
ii) moet deze subgroep patiënten vooraf kunnen worden geïdentificeerd, op het moment waarop het product in de handel wordt gebracht?
d. Indien het antwoord op de eerste prejudiciële vraag, onder b), bevestigend luidt, aan welke „speciale voedingsbehoeften” moet het gebruik van het product dan veilig, heilzaam en doeltreffend voldoen, als bedoeld in artikel 3?
2. Met betrekking tot de zinsnede „voor de behandeling waarvan niet louter met wijziging van het normale voedingspatroon noch met andere voedingsmiddelen voor bijzondere voeding, noch met een combinatie van beide, kan worden volstaan” in artikel 1, lid 2, onder b), hoe dient de mogelijkheid tot wijziging van het voedingspatroon te worden beoordeeld? Met name:
a. Zijn veiligheids- en praktische overwegingen bij een wijziging van het voedingspatroon relevant voor deze beoordeling? Zo ja, hoe dienen zij in aanmerking te worden genomen?
b. Moet een dergelijke mogelijkheid tot wijziging van het normale voedingspatroon (en indien relevant, veiligheids- en praktische overwegingen) worden beoordeeld:
i) in algemene zin, en vooraf, voor: i) een typische persoon met een typisch voedingspatroon met de typische bekwaamheid van een dergelijk persoon om zijn voedingspatroon te wijzigen, of ii) een typische patiënt met de geïndiceerde kwaal, met het voor een dergelijke patiënt typische voedingspatroon en de voor een dergelijke patiënt typische bekwaamheid om zijn voedingspatroon te wijzigen, of iii) andere hypothetische patiëntkenmerken?
ii) individueel en in de loop van de behandeling van de patiënt, gebruikmakend van het klinisch oordeel van de toezichthoudende klinisch medicus, zodat het volstaat dat een fabrikant het product in redelijkheid bestemt voor klinisch gebruik omdat een toezichthoudende klinisch medicus op redelijke, patiëntspecifieke gronden (bijvoorbeeld op voor de patiënt specifieke veiligheids- of praktische gronden) tot de conclusie kan komen dat voor bepaalde patiënten met de geïndiceerde kwaal het gebruik van dieetvoeding klinisch de voorkeur verdient boven andere vormen van wijziging van het voedingspatroon?
iii) of op andere wijze, en zo ja, hoe?
c. Omvat „wijziging van het normale voedingspatroon” het gebruik van „voedingssupplementen” als bedoeld in richtlijn 2002/46/EG betreffende de onderlinge aanpassing van de wetgevingen der lidstaten inzake voedingssupplementen, of van „verrijkte voedingsmiddelen” in de zin van verordening (EG) nr. 1925/2006 betreffende de toevoeging van vitaminen en mineralen en bepaalde andere stoffen aan levensmiddelen?
d. Wanneer een groep patiënten die aan een specifieke ziekte, aandoening of andere kwaal lijden zonder geheugensteuntje moeilijk kunnen onthouden een normaal voedingspatroon te volgen, kan dan een product dat is ontwikkeld om de consumptie van nutriënten die deel zouden uitmaken van het normale voedingspatroon, door zulke patiënten te vergemakkelijken, dieetvoeding voor medisch gebruik vormen als bedoeld in richtlijn 1999/21/EG van de Commissie van 25 maart 1999 betreffende dieetvoeding voor medisch gebruik?
Arts niet toerekenbaar vanwege afhankelijkheid heupprothesen producent
Rb. Rotterdam 19 augustus 2015, LS&R 1185; ECLI:NL:RBROT:2015:6179 (eiser tegen Stichting Gemini Ziekenhuis)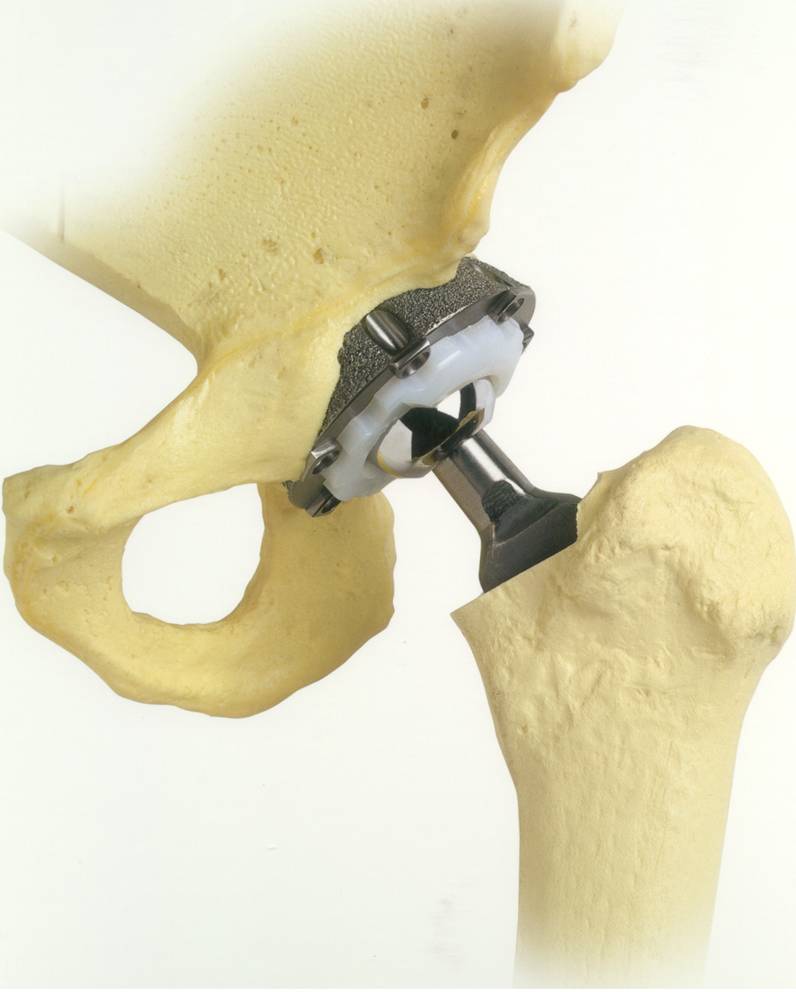 Overeenkomst van geneeskundige behandeling. In 2004 zijn metaal-op-metaal (MoM) heupprothesen van Biomet geplaatst. Na pijnklachten en verhoogde waarden voor chroom en kobalt vond in 2013 een revisie-operatie plaats. De rechtbank oordeelde dat de arts in 2004 niet wist of behoorde te weten van de gestelde risico's in verband met chroom- en kobalt-ionen bij het gebruik van MoM-prothesen. Bij de toepassing van hulpzaken van artikel 6:77 BW dient acht te worden geslagen op de relevante omstandigheden van het geval. Uitgangspunt is dat er sprake was van een niet te onderkennen gebrek. In dit geval is het niet redelijk de gestelde tekortkoming aan de arts toe te rekenen. Wat betreft de kwaliteit en eigenschappen van de heupprothesen is ook de arts afhankelijk geweest van de producent, zodat het niet direct voor de hand ligt om het gebrek voor risico van de arts te laten komen.
Overeenkomst van geneeskundige behandeling. In 2004 zijn metaal-op-metaal (MoM) heupprothesen van Biomet geplaatst. Na pijnklachten en verhoogde waarden voor chroom en kobalt vond in 2013 een revisie-operatie plaats. De rechtbank oordeelde dat de arts in 2004 niet wist of behoorde te weten van de gestelde risico's in verband met chroom- en kobalt-ionen bij het gebruik van MoM-prothesen. Bij de toepassing van hulpzaken van artikel 6:77 BW dient acht te worden geslagen op de relevante omstandigheden van het geval. Uitgangspunt is dat er sprake was van een niet te onderkennen gebrek. In dit geval is het niet redelijk de gestelde tekortkoming aan de arts toe te rekenen. Wat betreft de kwaliteit en eigenschappen van de heupprothesen is ook de arts afhankelijk geweest van de producent, zodat het niet direct voor de hand ligt om het gebrek voor risico van de arts te laten komen.
3.10.2. Tegen deze achtergrond komt de rechtbank tot het oordeel dat het in de omstandigheden van dit geval niet redelijk is de gestelde tekortkoming [gedaagde2] toe te rekenen. Daarbij is het volgende in aanmerking genomen.
Uitgangspunt in deze procedure is dat sprake is van een voor deskundige gebruikers in 2004 – redelijkerwijs – niet te onderkennen gebrek. (...) Bij de aard van de overeenkomst (van geneeskundige behandeling) past dat de patiënt op een aantal punten resultaat mag verlangen, bijvoorbeeld dat de prothese daadwerkelijk wordt geplaatst (behoudens bijzondere omstandigheden), dat de operatie volgens een aantal regels der kunst plaatsvindt, dat de chirurg over een aantal vaardigheden beschikt, et cetera. Ook mag de patiënt bepaalde eisen stellen ten aanzien van het gebruik van hulpmiddelen, zoals implantaten. Bij elk aspect van de geneeskundige behandeling zou moeten worden bezien in hoeverre resultaten mogen worden verlangd, dan wel (alleen) een inspanning om het beoogde doel te bereiken. (...) Maar wat betreft de kwaliteit en eigenschappen van de heupprothesen is ook [gedaagde2] afhankelijk geweest van de producent, zodat het niet direct voor de hand ligt om niet te onderkennen gebreken voor risico van [gedaagde2] te laten komen (en mogelijk op dit onderdeel niet onverkort van een resultaatsverbintenis kan worden gesproken).
Ongeoorloofde publieksreclame niet aannemelijk bij beperkte groep
CGR 31 juli 2015, LS&R 1184 (Geen sprake van ongeoorloofde publieksreclame bij een beperkte groep) Ongeoorloofde publieksreclame. Verzoek tot een multidisciplinair internationaal medisch congres die artsen, zorgprofessionals, wetenschappers en andere experts samenbrengt. Anderen dan de beroepsoefenaren hebben toegang tot de tentoonstellingsruimte en kunnen daardoor passief kennis nemen van de reclame die zichtbaar is vanuit de stands. Er is geen aanleiding om te veronderstellen dat de opzet van het congres ongeoorloofde publieksreclame zal zijn. De anderen dan beroepsbeoefenaren vormen in verhouding tot het aantal deelnemende beroepsbeoefenaren een beperkte groep (i.c. minder dan 1/3) die mede gelet op hun relatie tot de bepaalde groep van beroepsbeoefenaren of tot de congresorganisatie zelf, niet kunnen worden aangemerkt als "het brede publiek" waarop de definitie van publieksreclame ziet. De CGR acht de realisatie toelaatbaar.
Ongeoorloofde publieksreclame. Verzoek tot een multidisciplinair internationaal medisch congres die artsen, zorgprofessionals, wetenschappers en andere experts samenbrengt. Anderen dan de beroepsoefenaren hebben toegang tot de tentoonstellingsruimte en kunnen daardoor passief kennis nemen van de reclame die zichtbaar is vanuit de stands. Er is geen aanleiding om te veronderstellen dat de opzet van het congres ongeoorloofde publieksreclame zal zijn. De anderen dan beroepsbeoefenaren vormen in verhouding tot het aantal deelnemende beroepsbeoefenaren een beperkte groep (i.c. minder dan 1/3) die mede gelet op hun relatie tot de bepaalde groep van beroepsbeoefenaren of tot de congresorganisatie zelf, niet kunnen worden aangemerkt als "het brede publiek" waarop de definitie van publieksreclame ziet. De CGR acht de realisatie toelaatbaar.
2. Het oordeel van de CGR
De CGR gaat er onder de feitelijke door [X] voorgelegde omstandigheden vanuit dat de reclame voor receptgeneesmiddelen die zichtbaar zal zijn vanuit de stands van farmaceutische bedrijven, is bestemd voor de aan het congres deelnemende beroepsbeoefenaren. De CGR neemt daarbij aan dat deze reclame – gezien haar inhoud en de wijze waarop zij wordt geuit – niet kennelijk op anderen dan beroepsbeoefenaren is gericht of voor zodanige anderen is bestemd, althans het tegendeel blijkt niet uit de informatie die door [X] is verstrekt. Dat anderen dan beroepsbeoefenaren toegang hebben tot de tentoonstellingsruimte (zoals bij dit congres zorgprofessionals zonder voorschrijfbevoegdheid, wetenschappers en experts, werkend op het gebied van de [Y] zorg, maar ook congresmedewerkers, medewerkers van exposerende bedrijven en journalisten) en passief kennis kunnen nemen van de reclame die zichtbaar is vanuit de stands, is vooralsnog geen aanleiding te veronderstellen dat in de opzet van het congres sprake zal zijn van ongeoorloofde publieksreclame. De anderen dan beroepsbeoefenaren vormen in verhouding tot het aantal deelnemende beroepsbeoefenaren een beperkte groep (i.c. minder dan 1/3) die mede gelet op hun relatie tot de bedoelde groep van beroepsbeoefenaren of tot de 3 congresorganisatie zelf, niet kunnen worden aangemerkt als “het brede publiek” waarop de definitie van publieksreclame ziet. De conclusie uit het bovenstaande is als volgt. De CGR acht de hierboven omschreven opzet van het congres in beginsel in overeenstemming met de Gedragscode Geneesmiddelenreclame en acht de realisatie van deze opzet derhalve toelaatbaar.
Onduidelijke gerectificeerde onrechtmatige mededeling over inbreuk armondersteuning
Vzr. Rechtbank Den Haag 25 augustus 2015, IEF 15258; ECLI:NL:RBDHA:2015:10095 (Assistive Innovations tegen Microgravity Products)
 Rectificatie. Onrechtmatige mededelingen. Partijen hebben een niet-exclusieve overeenkomst voor de distributie van armondersteuningen. MGP is producent en ontwikkelaar, AI de distributeur die haar productportfolio in het buitenland wil uitbreiden met MGP-producten; dat verzoek wordt afgewezen en MGP zegt de leveringsovereenkomst op. MGP stuurt naar zorgverzekeraar CZ bericht over inbreuk op IE-rechten en heeft dit nauwelijks toegelicht en (onduidelijk) gerectificeerd. AI vordert met succes verbod op het doen van mededelingen en dat er gedurende 6 maanden een rectificatietekst op de website komt te staan.
Rectificatie. Onrechtmatige mededelingen. Partijen hebben een niet-exclusieve overeenkomst voor de distributie van armondersteuningen. MGP is producent en ontwikkelaar, AI de distributeur die haar productportfolio in het buitenland wil uitbreiden met MGP-producten; dat verzoek wordt afgewezen en MGP zegt de leveringsovereenkomst op. MGP stuurt naar zorgverzekeraar CZ bericht over inbreuk op IE-rechten en heeft dit nauwelijks toegelicht en (onduidelijk) gerectificeerd. AI vordert met succes verbod op het doen van mededelingen en dat er gedurende 6 maanden een rectificatietekst op de website komt te staan.
4.4. Vervolgens is de vraag aan de orde of hetgeen door MGP ter onthouding is toegezegd en is gerectificeerd voldoende is. Voorshands kan met AI daarbij worden aangenomen dat de rectificatie die door MGP is gestuurd onvoldoende duidelijk is. De gehanteerde tekst (zie r.o. 2.13) is voor tweeërlei uitleg vatbaar:
De eerlijkheid gebiedt ons u mede te delen dat wij de producten nog niet van Assistive Innovations op inbreuk hebben kunnen controleren en dat de inbreuk thans niet is komen vast te staan.
Ofwel zou de lezer kunnen begrijpen dat MGP de producten nog steeds niet op inbreuk heeft kunnen controleren waarmee de mogelijkheid open wordt gelaten dat daarop in een later stadium kan worden teruggekomen. Ofwel kan “thans” – zoals MGP kennelijk wilde – worden opgevat als “achteraf” of “bij nader inzien” of iets dergelijks, maar dan klopt de tegenwoordige tijd eerder in de zin niet meer.
AI heeft onbetwist gesteld dat er bij in elk geval één verzekeraar nog onduidelijkheid heerst(e). Hierbij is voorts van belang dat MGP – als gezegd – ook in dit geding op geen enkele wijze heeft toegelicht dat van inbreuk op enig recht sprake is of zou kunnen zijn. Indien gelezen als “slag om de arm” heeft deze voorshands dan ook geen grond en zorgt ten onrechte, zoals AI aanvoert, voor onduidelijkheid. Evenmin legt daarbij gewicht in de schaal dat MGP in de mening verkeerde dat de eerder in 2013 getoonde armsteun zou worden verhandeld, omdat ook daarvan niet in dit geding (onderbouwd) is gesteld dat deze inbreuk zou zijn op enig MGP toekomend recht van intellectuele eigendom. Dat betekent dat MGP te snel, zonder deugdelijk onderzoek en zonder nader juridisch advies een onjuiste mededeling aan derden (waaronder afnemers) heeft gedaan. Omdat tevens onvoldoende duidelijk is of de gestuurde rectificatie alle personen heeft bereikt die mogelijk de onjuiste mededeling hebben gezien, zal een rectificatietekst op de website van MGP als gevorderd worden toegewezen, evenwel met inachtneming van hetgeen hierna is te overwegen over de beëindiging van de distributierelatie.
4.11. Naar voorlopig oordeel dient een rectificatie van de onrechtmatige mededeling via de website van MGP plaats te vinden als na te melden. Tegen de termijn van zes maanden gedurende welke deze mededeling vermeld dient te blijven is door MGP geen verweer gevoerd. Voorts zal een verbod tot het verder doen van dergelijke mededelingen als gevorderd worden toegewezen nu dit niet in de onthoudingsverklaring is opgenomen. Verder geldt dat de distributierelatie weliswaar per 31 december 2015 is beëindigd maar dat MGP haar afnemer(s) niet mag verbieden tot 31 december 2016 nog de Armon Edero te leveren. Daarbij zal worden bepaald dat dit slechts heeft te gelden voor reeds thans gesloten contracten en voor zover deze, zonder nadere verlenging, tot 31 december 2016 doorlopen. Door plaatsing van de rectificatie op de website, is vooralsnog voldoende zeker gesteld dat alle ontvangers van de onjuiste mededeling worden bereikt, gegeven voorts de in de onthoudingsverklaring sub II opgenomen boete op niet zenden van de rectificatie aan ontvangers. Opgave van de namen en adressen van ontvangers, zoals AI voorts wenst, is in dat licht voorshands niet nodig, gegeven ook het bedrijfsgeheime karakter daarvan, waarop MGP heeft gewezen.
De vraag of er strijd is of was met Europees mededingingsrecht zal in het midden blijven.
5.2. gebiedt gedaagde binnen zeven dagen na betekening van dit vonnis voor de duur van zes maanden een rectificatietekst op te nemen op de website https://www.armonproducts.nl/verkooppunten.html naast Assistive Innovations (door middel van een link bereikbaar), met uitsluitend de volgende tekst::
"In het recente verleden hebben wij aan een aantal partijen meegedeeld, althans de indruk gewekt, dat Assistive Innovations B.V. inbreuk maakt en/of heeft gemaakt op een of meerdere intellectuele eigendomsrechten van Microgravity Products B.V. Bij vonnis d.d. 25 augustus 2015 heeft de voorzieningenrechter in de rechtbank Den Haag geoordeeld dat wij daardoor onrechtmatig hebben gehandeld omdat wij redelijkerwijs niet hebben kunnen menen dat van inbreuk op enige van onze intellectuele eigendomsrechten sprake is.
Hoogachtend,
…
Microgravity Products B.V."
Geen sprake van ontbreken essentiële informatie op tandpasta Dr. Organic
CvB 9 september 2015, LS&R 1181; dossiernr. 2015/00555 (Geen sprake van ontbreken essentiële informatie op tandpasta Dr. Organic)
 CvB gedeeltelijke aanbeveling. De uiting: Het betreft de (Engelstalige) verpakking van het product ‘Organic Aloe Vera Toothpaste’ van Dr. Organic. De klacht: Op de verpakking wordt geclaimd dat de tandpasta ‘organic’ oftewel biologisch is. Uit correspondentie met de NVWA en Bionext heeft klaagster begrepen dat een cosmeticafabrikant mag claimen dat zijn product biologisch is, dat hierop niet wordt gecontroleerd, maar dat de fabrikant desgevraagd de juistheid van de claim moet kunnen aantonen. Op klaagsters verzoek daartoe heeft adverteerder geen certificaten kunnen of willen overleggen van onafhankelijke instellingen die waarborgen dat de in de tandpasta gebruikte ingrediënten inderdaad biologisch zijn. Uiteindelijk heeft adverteerder aan klaagster wel de informatie verstrekt dat het hoofdingrediënt van de tandpasta in ieder geval biologisch is, maar een certificerende instantie is niet meegedeeld. Volgens klaagster is sprake van misleiding. CvB bekrachtigd bestreden beslissing.
CvB gedeeltelijke aanbeveling. De uiting: Het betreft de (Engelstalige) verpakking van het product ‘Organic Aloe Vera Toothpaste’ van Dr. Organic. De klacht: Op de verpakking wordt geclaimd dat de tandpasta ‘organic’ oftewel biologisch is. Uit correspondentie met de NVWA en Bionext heeft klaagster begrepen dat een cosmeticafabrikant mag claimen dat zijn product biologisch is, dat hierop niet wordt gecontroleerd, maar dat de fabrikant desgevraagd de juistheid van de claim moet kunnen aantonen. Op klaagsters verzoek daartoe heeft adverteerder geen certificaten kunnen of willen overleggen van onafhankelijke instellingen die waarborgen dat de in de tandpasta gebruikte ingrediënten inderdaad biologisch zijn. Uiteindelijk heeft adverteerder aan klaagster wel de informatie verstrekt dat het hoofdingrediënt van de tandpasta in ieder geval biologisch is, maar een certificerende instantie is niet meegedeeld. Volgens klaagster is sprake van misleiding. CvB bekrachtigd bestreden beslissing.
Het oordeel van het College:
1. Het College stelt voorop dat de klacht betrekking heeft op een cosmetisch product (tandpasta) waarvan niet in geschil is dat het voor minimaal 70% uit ingrediënten bestaat die volgens een certificerende instantie ‘organic’ mogen worden genoemd. Ingevolge de beslissing van de Commissie zal Dr. Organic dit minimumpercentage op de verpakking gaan vermelden, hetgeen volgens haar inmiddels ook gebeurt. In beroep dient te worden beoordeeld of Dr. Organic naast dit minimumpercentage tevens op de verpakking van de tandpasta had dienen te vermelden welke specifieke ingrediënten ‘organic’ zijn en welke specifieke instantie dit heeft gecertificeerd.
2. Artikel 19 van Verordening (EG) 1223/2009 betreffende cosmetische producten bepaalt aan welke eisen de etikettering van dergelijke producten dient te voldoen. In dit kader is van belang dat een lijst van ingrediënten dient te worden vermeld. De bestreden verpakking voldoet aan deze eis. Uit bedoeld artikel of de verdere bepalingen van Verordening (EG) 1223/2009 volgt echter niet dat per afzonderlijk ingrediënt dient te worden vermeld welk ‘organic’ is. Een dergelijke verplichting volgt evenmin uit de Reclamecode Cosmetische Producten (RCP). Voor zover de aanduiding ‘organic’ op de verpakking zou verwijzen naar het begrip biologisch als gedefinieerd in Verordening (EG) Nr. 834/2007 inzake de biologische productie en de etikettering van biologische producten, is ook dit geen reden om te oordelen dat op Dr. Organic de door appellante bedoelde specificatieplichten rusten. Verordening (EG) Nr. 834/2007 is immers niet van toepassing op cosmetische producten zoals tandpasta in de zin van Verordening (EG) 1223/2009.
3. Uit het voorgaande volgt dat in dit geval op Dr. Organic geen wettelijke plicht rust om per afzonderlijk ingrediënt te specificeren of dit ‘organic’ is. Hieruit volgt tevens dat geen wettelijke verplichting bestaat om per ingrediënt de certificerende instantie te noemen. Met betrekking tot de vraag of de gemiddelde consument door het ontbreken van deze informatie wordt misleid, oordeelt het College dat geen sprake is van (het ontbreken van) essentiële informatie die de gemiddelde consument nodig heeft om een geïnformeerd besluit over een transactie te nemen. Het College gaat in dit verband ervan uit dat het deze consument vooral te doen is om de vraag voor welk percentage het product is samengesteld uit ‘organic’ ingrediënten. Niet kan worden aangenomen dat de consument door het ontbreken van verdere informatie over het karakter van de afzonderlijke ingrediënten zal besluiten tot een transactie waartoe hij niet besloten zou hebben indien op de verpakking specifiek had gestaan welke ingrediënten ‘organic’ zijn en welke instantie dit heeft gecertificeerd.
4. Het voorgaande brengt mee dat de grieven niet kunnen slagen, zodat wordt beslist als volgt.
De beslissing van het College van Beroep
Het College bekrachtigt de bestreden beslissing voor zover in beroep aan de orde.

















