HvJ EU: Richtlijn medische hulpmiddelen staat indeling product als geneesmiddel toe
HvJ EU 3 oktober 2013, zaak C-109-/12 (Labaratoires Lyocentre) - dossier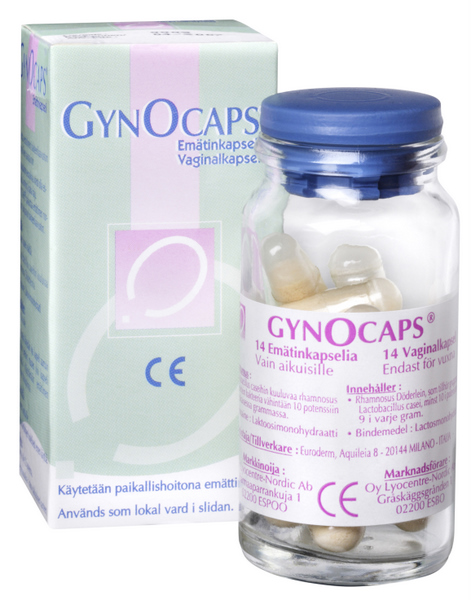 Zie eerder LSenR. Verzoek om een prejudiciële beslissing, Korkein hallinto-oikeus. Uitlegging van richtlijn 93/42/EEG van de Raad van 14 juni 1993 betreffende medische hulpmiddelen (PB L 169, blz. 1) en richtlijn 2001/83/EG van het Europees Parlement en de Raad van 6 november 2001 tot vaststelling van een communautair wetboek betreffende geneesmiddelen voor menselijk gebruik (...). Vaginaal preparaat met levende melkzuurbacteriën. Recht van bevoegde nationale instantie om een in een andere lidstaat als medisch hulpmiddel verkocht preparaat met een EG-markering in de zin van richtlijn 93/42 op basis van zijn farmacologisch, immunologisch of metabolisch effect te kwalificeren als geneesmiddel in de zin van richtlijn 2001/83. Het Hof verklaart voor recht:
Zie eerder LSenR. Verzoek om een prejudiciële beslissing, Korkein hallinto-oikeus. Uitlegging van richtlijn 93/42/EEG van de Raad van 14 juni 1993 betreffende medische hulpmiddelen (PB L 169, blz. 1) en richtlijn 2001/83/EG van het Europees Parlement en de Raad van 6 november 2001 tot vaststelling van een communautair wetboek betreffende geneesmiddelen voor menselijk gebruik (...). Vaginaal preparaat met levende melkzuurbacteriën. Recht van bevoegde nationale instantie om een in een andere lidstaat als medisch hulpmiddel verkocht preparaat met een EG-markering in de zin van richtlijn 93/42 op basis van zijn farmacologisch, immunologisch of metabolisch effect te kwalificeren als geneesmiddel in de zin van richtlijn 2001/83. Het Hof verklaart voor recht:
1) Het feit dat een product in een lidstaat krachtens richtlijn 93/42/EEG van de Raad van 14 juni 1993 betreffende medische hulpmiddelen, (...) als medisch hulpmiddel met EG-markering is ingedeeld, staat niet eraan in de weg dat de bevoegde autoriteiten van een andere lidstaat ditzelfde product wegens het farmacologische, immunologische of metabolische effect ervan indelen als geneesmiddel in de zin van artikel 1, punt 2, sub b, van richtlijn 2001/83/EG van het Europees Parlement en de Raad van 6 november 2001 tot vaststelling van een communautair wetboek betreffende geneesmiddelen voor menselijk gebruik (...).
2) De bevoegde autoriteiten van een lidstaat moeten, teneinde een product dat in een andere lidstaat krachtens richtlijn 93/42, zoals gewijzigd bij richtlijn 2007/47, reeds is ingedeeld als medisch hulpmiddel met EG-markering, krachtens richtlijn 2001/83, zoals gewijzigd bij verordening nr. 1901/2006, in te delen als geneesmiddel, de procedure van artikel 18 van richtlijn 93/42, zoals gewijzigd bij richtlijn 2007/47, en, in voorkomend geval, deze van artikel 8 van die richtlijn 93/42 toepassen alvorens zij de indelingsprocedure van richtlijn 2001/83, zoals gewijzigd bij verordening nr. 1901/2006, toepassen.
3) Binnen eenzelfde lidstaat kan een product dat weliswaar niet identiek is aan een ander, als geneesmiddel ingedeeld product, maar daarmee toch eenzelfde bestanddeel gemeen heeft en hetzelfde werkingsmechanisme heeft, in beginsel niet krachtens richtlijn 93/42, zoals gewijzigd bij richtlijn 2007/47, in de handel worden gebracht als medisch hulpmiddel, tenzij een ander uit het oogpunt van artikel 1, lid 2, sub a, van die richtlijn 93/42 relevant kenmerk dat eigen is aan een dergelijk product vereist dat dit product als medisch hulpmiddel wordt aangemerkt en in de handel wordt gebracht, wat door de verwijzende rechter dient te worden beoordeeld.
Gestelde vragen:
1) Wanneer een preparaat in een lidstaat overeenkomstig richtlijn 93/42 is gekwalificeerd als een medisch hulpmiddel met een EG-markering in de zin van deze richtlijn, is het dan uitgesloten dat de bevoegde autoriteit van een andere lidstaat dit preparaat op basis van het farmacologische, immunologische of metabolische effect ervan indeelt als geneesmiddel in de zin van artikel 1, lid 2, sub b, van richtlijn [2001/83]?
2) Indien de vorige vraag ontkennend wordt beantwoord, kan deze nationale autoriteit het preparaat alleen met inachtneming van de procedures van richtlijn [2001/83] als geneesmiddel indelen of moeten, alvorens de procedure tot indeling als geneesmiddel volgens deze richtlijn wordt begonnen, de vrijwaringsprocedure van artikel 8 van richtlijn [93/42] of de voorschriften over onrechtmatig aangebrachte EG-markeringen in de zin van artikel 18 van deze richtlijn worden gevolgd?
3) Sluiten richtlijn [2001/83], richtlijn [93/42] of andere bepalingen van Unierecht (met name inzake de bescherming van de gezondheid en het leven van de mens en de consumentenbescherming) uit dat preparaten met hetzelfde bestanddeel en dezelfde werkingsmechanismen op het grondgebied van één en dezelfde lidstaat op de markt zijn als zowel geneesmiddel dat een vergunning voor het in de handel brengen in de zin van richtlijn 2001/83/EG vereist, als medisch hulpmiddel in de zin van richtlijn [93/42]?
 Een bijdrage van Erik Vollebregt,
Een bijdrage van Erik Vollebregt,  Gezondheid. Geneesmiddelen en medische behandelingen. Aanbeveling. Het betreft een televisiereclame. Daarin vertelt een vrouw dat zij zich in verband met spataderen heeft laten behandelen bij Bergman Clinics. Zij vertelt dat haar spataderen “helemaal weg” zijn en zegt: “Het wordt ook nog vergoed”. De voice-over luidt: “Ga voor specialistische spataderzorg naar Bergman Clinics. Kijk op bergmanclinics.nl. In beeld verschijnt: “Eerste spataderconsult altijd vergoed met verwijzing van uw huisarts”.
Gezondheid. Geneesmiddelen en medische behandelingen. Aanbeveling. Het betreft een televisiereclame. Daarin vertelt een vrouw dat zij zich in verband met spataderen heeft laten behandelen bij Bergman Clinics. Zij vertelt dat haar spataderen “helemaal weg” zijn en zegt: “Het wordt ook nog vergoed”. De voice-over luidt: “Ga voor specialistische spataderzorg naar Bergman Clinics. Kijk op bergmanclinics.nl. In beeld verschijnt: “Eerste spataderconsult altijd vergoed met verwijzing van uw huisarts”. Namaak. Import in EER. Vrijwaring toegewezen. Novartis is houdster van gemeenschapswoord- /beeldmerk
Namaak. Import in EER. Vrijwaring toegewezen. Novartis is houdster van gemeenschapswoord- /beeldmerk %20wikimedia.png) Begripsomschrijving. Als ‘vervalst’ worden in de richtlijn aangemerkt geneesmiddelen met een valse voorstelling van identiteit (verpakking, etikettering, naam of samenstelling), oorsprong (fabrikant, houder van de handelsvergunning, land van herkomst) of geschiedenis (blijkend uit de documentatie over distributie). Dit is dus een ruime definitie van vervalsingen (zie ook bijlage 15). In feite gaat het om alle geneesmiddelen die op enigerlei wijze worden gepresenteerd als legaal geproduceerd of gedistribueerd. Het is in die definitie niet van belang of tevens geprobeerd wordt om dergelijke geneesmiddelen zo veel mogelijk te laten lijken op bestaande geneesmiddelen die al in het handelskanaal zijn (de klassieke merkvervalsing).
Begripsomschrijving. Als ‘vervalst’ worden in de richtlijn aangemerkt geneesmiddelen met een valse voorstelling van identiteit (verpakking, etikettering, naam of samenstelling), oorsprong (fabrikant, houder van de handelsvergunning, land van herkomst) of geschiedenis (blijkend uit de documentatie over distributie). Dit is dus een ruime definitie van vervalsingen (zie ook bijlage 15). In feite gaat het om alle geneesmiddelen die op enigerlei wijze worden gepresenteerd als legaal geproduceerd of gedistribueerd. Het is in die definitie niet van belang of tevens geprobeerd wordt om dergelijke geneesmiddelen zo veel mogelijk te laten lijken op bestaande geneesmiddelen die al in het handelskanaal zijn (de klassieke merkvervalsing). Mevrouw Dijkstra (D66) heeft tijdens het VAO een motie (
Mevrouw Dijkstra (D66) heeft tijdens het VAO een motie (.gif)
 2. Is Souvenaid volgens u een geneesmiddel of een dieetdrankje? Kunt u uw antwoord toelichten?
2. Is Souvenaid volgens u een geneesmiddel of een dieetdrankje? Kunt u uw antwoord toelichten? In 't kort: Prejudiciële vragen. Geneesmiddelen. Sondevoeding. Het Hof heeft geoordeeld dat vijf verschillende soorten sondevoeding moeten worden aangemerkt als 'andere alcoholvrije dranken'. Voorts heeft zij geoordeeld dat deze producten niet kunnen worden ingedeeld onder post 3004 van de GN. De Hoge Raad verzoekt het Hof van Justitie van de Europese Unie uitspraak te doen over de volgende twee vragen:
In 't kort: Prejudiciële vragen. Geneesmiddelen. Sondevoeding. Het Hof heeft geoordeeld dat vijf verschillende soorten sondevoeding moeten worden aangemerkt als 'andere alcoholvrije dranken'. Voorts heeft zij geoordeeld dat deze producten niet kunnen worden ingedeeld onder post 3004 van de GN. De Hoge Raad verzoekt het Hof van Justitie van de Europese Unie uitspraak te doen over de volgende twee vragen:














