Niet aannemelijk: binnen enkele weken zichtbaar resultaat
RCC 2 juli 2012, dossiernr. 2012/00482 (Nailner repair)
 Het betreft een tv-commercial voor het product Nailner Repair waarin zonder enige beperking wordt gezegd: "De Nailner formule dringt door het oppervlak van de nagel heen en geeft binnen enkele weken zichtbaar resultaat." Dat is bij klager niet het geval; zelfs na één jaar is er nog geen enkel resultaat.
Het betreft een tv-commercial voor het product Nailner Repair waarin zonder enige beperking wordt gezegd: "De Nailner formule dringt door het oppervlak van de nagel heen en geeft binnen enkele weken zichtbaar resultaat." Dat is bij klager niet het geval; zelfs na één jaar is er nog geen enkel resultaat.
Uit een e-mail van de Consumentenservice Nailner Repair begrijpt klager dat het product niet bij iedereen werkt. Dit dient uit de reclame te blijken. De KOAG/KAG heeft laten toevoegen dat de uitgroei van de teennagel 8 tot 12 maanden vergt. Het uiteindelijke resultaat van het gebruik van het product kan vanzelfsprekend van individu tot individu verschillen.
Omega distribueert het merk Nailner Repair voor het bedrijf YouMedical en de Commissie stelt voorop dat beide verweerders verantwoordelijk worden geacht voor de reclame. Medner heeft met een simpele verwijzing naar een studie (zonder toe te lichten op welke plaats verslag wordt gedaan, wat bedoeld wordt met positief resultaat en het aantal/percentage gebruikers bij wie in vier weken positief resultaat werd bereikt), niet aannemelijk gemaakt dat in het algemeen binnen enkele weken zichtbaar resultaat kan worden bereikt.
Klacht wordt deels gegrond verklaard vanwege strijd met 8.2 aanhef en onder b NRC jo. 7 NRC. In de uiting ligt niet de suggestie besloten dat een ieder onder alle omstandigheden baat zal vinden bij gebruik van het product.
3. Nu in de bestreden uiting zonder voorbehoud is gesteld: “De Nailner formule (…) geeft binnen enkele weken zichtbaar resultaat”, zonder dat verweerders aannemelijk hebben gemaakt dat in het algemeen een dergelijk resultaat kan worden bereikt, acht de Commissie de reclame voor de gemiddelde consument onduidelijk ten aanzien van de van het gebruik van Nailner Repair te verwachten resultaten als bedoeld in artikel 8.2 aanhef en onder b van de Nederlandse Reclame Code (NRC). Nu de gemiddelde consument er bovendien toe kan worden gebracht een besluit over een transactie te nemen, dat hij anders niet had genomen, is de uiting misleidend en daardoor oneerlijk in de zin van artikel 7 NRC.
4. Voor zover klager stelt dat uit de reclame dient te blijken dat het product niet bij iedereen werkt, wijst de Commissie de klacht af. In de uiting ligt niet de suggestie besloten dat een ieder onder alle omstandigheden baat zal vinden bij gebruik van het product.
Social media in relatie tot de Gedragscode Geneesmiddelenreclame
Stichting CGR, Social Media, Nieuwsbrief 2012-4.
 Uit de nieuwsbrief: Social media als Facebook. LinkedIn, twitter, blogs, discussiefora, Google en wiki zijn niet meer weg te denken in onze huidige manier van communiceren. En daarbij genieten de
Uit de nieuwsbrief: Social media als Facebook. LinkedIn, twitter, blogs, discussiefora, Google en wiki zijn niet meer weg te denken in onze huidige manier van communiceren. En daarbij genieten de
onderwerpen gezondheid, ziekten en behandelmethoden een grote populariteit.
Regelmatig worden ons vragen gesteld over social media in relatie tot de Gedragscode Geneesmiddelenreclame (hierna: de Gedragscode). De Gedragscode kent geen expliciete bepalingen over social media, maar is wel degelijk van toepassing, gezien de ruime definitie van reclame.
Hoofdregel is: wat “offline” geldt, geldt ook voor “online”. In deze nieuwsbrief zal nader worden ingegaan op de bijzondere kenmerken en toepassingen van social media in relatie tot de Gedragscode. Eventuele verplichtingen uit hoofde van de Wet bescherming persoonsgegevens of de Telecommunicatiewet, blijven buiten beschouwing.
De Gedragscode en social media
Voor social media geldt veelal dat het bereik niet bij de landsgrenzen ophoudt. De Gedragscode is alleen van
toepassing op uitingen die in Nederland toegankelijk zijn en wat woord en inhoud betreft, onmiskenbaar op het
Nederlandse publiek zijn gericht. Dit kan worden vastgesteld aan de hand van:
1. de taal waarin de uiting is gesteld;
2. de nationaliteit van de provider;
3. de vraag of en (zo ja) de wijze waarop de social media in nationale media wordt aangekondigd;
4. aanwezigheid van referenties aan het gebruik, de beschikbaarheid of de prijs van (bepaalde) geneesmiddelen in Nederland;
5. illustratieve aankleding en andere associaties met Nederland.
Het enkele feit dat het geneesmiddel ook in Nederland verkrijgbaar is, is niet doorslaggevend.
Algemene eisen die gelden voor social media:
1. Reclame moet altijd als zodanig herkenbaar zijn;
2. Herkenbaarheid van degene die de boodschap stuurt of (mede)verantwoordelijk is voor de inhoud daarvan;
3. Bepaalbaarheid van de geadresseerden (zie hieronder);
4. Verantwoordelijkheid voor de inhoud van eigen websites en media waarnaar wordt verwezen (gelinkt).
Bij het gebruik van social media is van belang dat het verbod op publieksreclame voor recept-geneesmiddelen in acht wordt genomen en publieksinformatie in overeenstemming is met de Leidraad informatie URgeneesmiddelen (hierna: de Leidraad). Dit betekent dat de geadresseerden goed moeten kunnen worden geïdentificeerd en geselecteerd. Social media kennen daar technische mogelijkheden voor door middel van preregistratie en/of gebruik van gebruikersnaam en
wachtwoord.
Verder is van belang dat informatie die door de farmaceutische onderneming via social media wordt verkregen over met name bijwerkingen van geneesmiddelen, worden opgevolgd binnen de geldende regels van farmacovigilantie.
Uitleg van het begrip 'Informed consent'
Rechtbank Rotterdam 18 april 2012, LJN BW4629 (eiser tegen Stichting Franciscus Gasthuis)
L etselschade, aansprakelijkheid, medische behandeling, informed consent, medische fout, , dilatatietherapie. Dit vonnis spreekt over een uitgebreide uiteenzetting van de 'informed consent' voorafgaand aan een operatieve ingreep en behandeling van een complicatie. De zaak wordt aangehouden, want er wordt een deskundige aangewezen.
etselschade, aansprakelijkheid, medische behandeling, informed consent, medische fout, , dilatatietherapie. Dit vonnis spreekt over een uitgebreide uiteenzetting van de 'informed consent' voorafgaand aan een operatieve ingreep en behandeling van een complicatie. De zaak wordt aangehouden, want er wordt een deskundige aangewezen.
Informed consent
Op de hulpverlener rust een informatieplicht. De hulpverlener licht de patiënt op duidelijke wijze, en desgevraagd schriftelijk in over het voorgenomen onderzoek en de voorgestelde behandeling en over de ontwikkelingen omtrent het onderzoek, de behandeling en de gezondheidstoestand van de patiënt (artikel 7:448, lid 1, BW). Bij het uitvoeren van voornoemde verplichting laat de hulpverlener zich leiden door hetgeen de patiënt redelijkerwijze dient te weten ten aanzien van:
a. de aard en het doel van het onderzoek of de behandeling die hij noodzakelijk acht en van de uit te voeren verrichtingen;
b. de te verwachten gevolgen en risico's daarvan voor de gezondheid van de patiënt;
c. andere methoden van onderzoek of behandeling die in aanmerking komen;
d. de staat van en de vooruitzichten met betrekking tot diens gezondheid voor wat betreft het terrein van het onderzoek of de behandeling (artikel 7:448, lid 2, BW).
(...)
Een hulpverlener kan zich in beginsel slechts op door de patiënt verleende toestemming beroepen indien die patiënt voorafgaande aan het verlenen van toestemming naar behoren was geïnformeerd. Wat in dit verband "naar behoren informeren" inhoudt, is afhankelijk van de concrete omstandigheden van het geval. Daarbij kunnen aspecten aan de orde zijn als:
- Bestaan er voor patiënt reële keuzemogelijkheden. Dat is bijvoorbeeld het geval indien de patiënt zonder het risico op gezondheidsschade kan besluiten een behandeling niet te ondergaan, of te kiezen voor een andere behandeling. Des te reëler de keuzemogelijkheden van de patiënt zijn des te belangrijker is het dat de patiënt goed over de verschillende alternatieven en de daaraan verbonden voor- en nadelen wordt geïnformeerd.
- Hoe groot zijn de aan een behandeling verbonden risico's en hoe ernstig kunnen de gevolgen zijn indien zich een dergelijk risico realiseert. Des te groter de risico's en des te ernstiger de mogelijke gevolgen, des te beter de patiënt daarover zal dienen te worden geïnformeerd.
- Welke informatie wenst de patiënt te verkrijgen en in welke mate is de patiënt in staat om die informatie te begrijpen en mede op basis daarvan keuzes te maken. Naarmate een patiënt en de zijnen minder behoefte hebben aan uitgebreide informatie en minder in staat zijn om de informatie te begrijpen en om mede op basis daarvan keuzes te maken omtrent de behandeling, ligt het in de rede dat de te verstrekken informatie minder gedetailleerd zal behoeven te zijn.
- Bestaat er binnen de beroepsgroep consensus over de informatie die in een bepaald geval behoort te worden verstrekt. Indien dit het geval is, hetgeen bijvoorbeeld tot uitdrukking kan komen in patiëntenbrochures, dan ligt het in de rede dat in ieder geval die informatie zal worden verstrekt.
Informed consent - operatieve ingreep
(...) Of [eiser] er over had behoren te worden geïnformeerd dat de slikklachten zo ernstig zouden kunnen zijn als in de praktijk is gebleken, is (mede) afhankelijk van de grootte van het risico op dergelijk ernstige slikklachten, de mogelijkheden om die vervolgens te verhelpen en de daaraan verbonden risico's, alsmede van de ernst van het gezondheidsprobleem dat men beoogde met de ingreep van 15 juli 2004 te verhelpen en de beschikbare alternatieven voor de voorgestelde ingreep.
Uit de stellingen van [eiser] en hetgeen zij ter zitting heeft opgemerkt, kan worden opgemaakt dat zij heeft bedoeld te stellen dat zij geen toestemming voor de operatie zou hebben verleend indien zij volledig zou zijn geïnformeerd.
Informed consent - behandeling complicatie
De stelling van Sint Franciscus Gasthuis dat "de hoop en verwachting bestond" dat de na de operatie gebleken problemen met behulp van de dilataties konden worden opgelost, kan de rechtbank niet rijmen met de erkenning van [X] ter zitting dat het percentage patiënten dat baat heeft bij dilatatietherapie - naar de rechtbank aanneemt in een geval als het onderhavige - kleiner is dan 20%. Bij een succeskans van minder dan 20% was immers geen sprake van een reële verwachting dat de problemen met behulp van de dilataties zouden kunnen worden opgelost.
Beoordeeld dient te worden of redelijk bekwaam en redelijk handelend vakgenoten van [X] en [Y] in de gegeven omstandigheden dilatatietherapie zouden hebben geadviseerd in plaats van re-operatie, alsmede of aannemelijk is dat een patiënt voor dilatatietietherapie zou hebben gekozen na adequate voorlichting. Teneinde dit te kunnen beoordelen dient meer inzicht te worden verkregen in de mogelijkheden, kansen en risico's.(...)
Deskundige
Uit hetgeen hiervoor is overwogen, vloeit voort dat de rechtbank het noodzakelijk acht zich te laten adviseren door een onafhankelijk deskundige. Weliswaar is reeds een advies van een deskundige beschikbaar in de vorm van de door [eiser] overgelegde brief van [Z], maar de aan [Z] voorgelegde vragen - welke niet aan de rechtbank bekend zijn gemaakt - hebben kennelijk niet alle hiervoor genoemde door de rechtbank relevant geachte aspecten omvat. Bovendien is het advies niet uitgebracht op gezamenlijk verzoek van partijen op basis van een gezamenlijke vraagstelling en door een in overleg tussen (de medisch adviseurs van partijen) gekozen deskundige. Daarmee is de processuele waarde van het advies van [Z] ook beperkt.
Testimonial van een "gewone" consument
RCC 24 juli 2012, dossiernr. 2012/00551 (Brandend maagzuur? Renate weet raad)
 In een weekblad staan advertorials waarin Rennie en Losecosan worden aangeprezen door Renate (een moeder van drie kinderen en schooljuf)
In een weekblad staan advertorials waarin Rennie en Losecosan worden aangeprezen door Renate (een moeder van drie kinderen en schooljuf)
Klacht: Er wordt advies gegeven over het gebruik van maagzuurremmende middelen, dit mag uitsluitend door een professional of gediplomeerde drogist/apotheker worden gedaan (strijd met 8,9,10,15,16,17,18,20,24,25 Code Publieksreclame voor Geneesmiddelen).
Het verweer dat een testimonial van een "gewone" consument mag en de KOAG/KAG heeft de uiting goedgekeurd en van een toelatingsnummer voorzien wordt door KOAG/KAG ondersteund. De klacht wordt afgewezen.
KOAG/KAG: In de advertorials is sprake van een aanbeveling van een "gewone" consument en niet van een aanbeveling door een beroepsbeoefenaar, wetenschapper of persoon met een zekere reputatie op het gebied van geneesmiddelen, wat volgens artikel 19 van de Bijzondere Reclamecode CPG niet is toegestaan. De advertorials voldoen aan de geldende wet- en regelgeving in het algemeen en de CPG in het bijzonder.
De Commissie vat klaagsters voornaamste bezwaar tegen de onderhavige - door de KOAG goedgekeurde - reclame-uitingen aldus op, dat sprake is van een aanbeveling van maagzuurremmende middelen door iemand die daartoe niet gekwalificeerd is. Op grond van artikel 19 CPG mag reclame echter niet direct of indirect een aanprijzing bevatten van wetenschapsbeoefenaren of beroepsbeoefenaren in de gezondheidszorg, waartoe de volgens klaagster wel gekwalificeerde “professional” en “gediplomeerd drogist/apotheker” gerekend moeten worden. Niet kan worden geoordeeld dat “Renate” door haar beroep van onderwijzeres op een basisschool gezag geniet op het gebied van geneesmiddelen en om die reden - op basis van artikel 19 CPG - niet de producten Rennie en Losecosan 20 zou mogen aanprijzen.
Van strijd met de overige door klaagster aangehaalde artikelen uit de CPG is de Commissie evenmin gebleken.
Niet iedere werkingsfase in beeld gebracht
Vz. (afwijzing) RCC 7 maart 2012, dossiernr. 2012/00163 (Bisolvon in de longen)
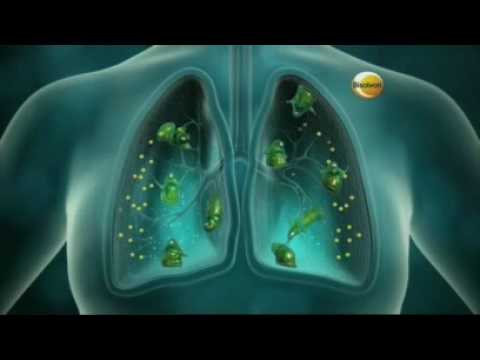 In een televisiereclame wordt door middel van een schematische weergaven van de borst toegelicht hoe Bisolvon werkt.
In een televisiereclame wordt door middel van een schematische weergaven van de borst toegelicht hoe Bisolvon werkt.
In de animatie die in de uitingen wordt getoond is te zien dat Bisolvon wordt gedronken, waarna dit het vastzittende slijm in de luchtwegen oplost. Klacht: Wat men eet en drinkt komt echter in de slokdarm en niet in de luchtweg. Ten onrechte wordt de indruk gewekt dat Bisolvon, na het drinken daarvan, in de longen terechtkomt. De uiting is om die reden misleidend.
De voorzitter wijst de klacht af en overweegt dat de korte animatiebeelden op een versimpelde wijze de werking uitlegt: het innemen en de laatste fase, het moment dat Bisolvon zijn werk doet, wordt in beeldgebracht zonder tussenliggende fase te tonen.
De voorzitter is van oordeel dat de klacht de Commissie geen aanleiding zal geven een aanbeveling te doen. Hij overweegt daartoe het volgende.
Door middel van enkele korte animatie-beelden wordt op versimpelde wijze getoond wat in de uiting over de werking van Bisolvon wordt gezegd, in die zin dat de eerste, het innemen van Bisolvon, en de laatste fase, het moment waarop Bisolvon in de longen zijn werk doet, in beeld worden gebracht. Dat niet iedere fase die Bisolvon doorloopt wordt getoond, leidt niet tot het oordeel dat de uitingen misleidend zijn.
QR-code hulpmiddel, maar geen oplossing voor bestrijding namaakmedicijnen
 Een bijdrage van Corina Post-Wolfert, Abcor Merkenbureau.
Een bijdrage van Corina Post-Wolfert, Abcor Merkenbureau.
Eerder gepubliceerd in het Noordhollands Dagblad. Snel geld verdienen wil iedereen wel. Over het algemeen moet je hiervoor hard werken of geluk hebben in de loterij. Ben je creatief dan kan een uitvinding tot succes leiden. Er zijn dan altijd anderen die graag willen aanhaken aan dit success en dit gebeurd dan niet altijd eerlijk. Het product wordt nagemaakt en het merk van de ander wordt er opgezet. We kennen allemaal de op grote schaal nagemaakte kleding (Adidas), schoenen (Convers), tassen (Louis Vuiton), parfums (Chanel), toiletartikelen (Gilette) etc. Door de opkomst van het electronische dataverkeer is het bestrijden van de nepartikelen een lastige strijd geworden.
Het verbieden van de website van een aanbieder van nep-producten (counterfeiter) is weinig effectief. De counterfeiter zal via een andere website zijn producten blijven aanbieden. De creativeit van een counterfeiter is ook toegenomen. Via blurring maken zij het uiterlijke van een verpakking wazig zodat het onduidelijk is dat het om een merkproduct gaat. Of bij een zoekopdracht is het niet gelijk duidelijk wie een merkproduct aanbied. Verschillende velden moeten hiervoor namelijk open geklikt worden om hier achter te komen.
De houder van het merkartikel loopt door productvervalsing vele miljoenen aan inkomsten mis. De consument ondervindt enige hinder wanneer het nep-product van slechte kwaliteit is. Het is echter levensbedreigend wanneer het om een medicijn gaat dat niet of te weinig van de werkzame stof bevat. Medicijnvervalsing is een wereldwijd probleem dat in raptempo toeneemt. De counterfeiters zijn vaak goed georganiseerde maffiabendes die hun terrein verlegd hebben van de (party)drugs naar medicijnen. De winst is hoog, de pakkans is klein en de straffen zijn laag.
De meeste medicijnen die worden nagemaakt zijn lifestyle medicijnen tegen bijvoorbeeld allergie (ALLERFREE), erectiestoornis (VIAGRA) of depressies ( SEROQUEL). Deze medicijnen worden voornamelijk aangeboden in welvarende landen. In de ontwikkelingslanden worden medicijnen nagemaakt die een life-threatening conditie hebben, te denken valt aan: malaria, tuberculosis en HIV/AIDS. Door de jaren heen worden ook de dure anti-kanker medicijnen nagemaakt en de populaire anti-virale medicijnen. Om hoeveel medicijnvervalsing het per jaar gaat, is niet precies bekend. De World Health Organisatie (WHO) schat dat de helft van de medicijnen die aangeboden worden op het internet nep zijn.
Het is soms lastig om nep van echt te onderscheiden. Dit komt omdat de machines van de counterfeiters van de nieuwste kwaliteit zijn waardoor de nep-medicijnen er vaak bijzonder goed uitzien. Pas als het medicijnen onder de loep wordt gelegd, blijkt dat het een andere samenstelling te hebben. Uit onderzoek blijkt bijvoorbeeld dat malariatabletten te weinig Arthemisine bevatten waardoor bij gebruik de malariamug niet dood gaat maar juist resistent wordt door het gebruik van het medicijn. Anti-kanker medicijnen kunnen zuren of rattengif bevatten om de patient te laten denken dat het medicijn werkt omdat zij misselijk worden. In werkelijkheid worden zij nog zieker gemaakt. In andere gevallen blijken de medicijnen perfect nagemaakt te zijn. Laboratorium onderzoek moet dan uitwijzen of de gebruikte actieve stoffen anders zijn dan het origineel. Op het internet is het niet te zien dat het om het echte medicijn gaat. Bij het aanbieden van nepmedicijnen op een website zal de inbreukmakende producent er alles aan doen om de verpakking er zo goed mogelijk uit te laten zien om de koper de indruk te geven dat het om het originele product gaat.
De gevolgen van counterfeit strekken zich niet alleen uit tot de patient maar ook tot de farmaceutische industrie zelf. In vergelijkende studies met een comparator moet de industrie bij de aankoop van het vergelijkende medicijn ook uitkijken dat zij niet namaak producten gaat gebruiken. Een studie is dan “at risk” omdat de gegevens niet meer kloppen. Tevens loopt de proefpersonen in de klinische studie een mogelijk gevaar wanneer zij een namaakmedicijn toegediend krijgen. De industrie doet er daarom goed aan om het comparator medicijn af te nemen van de reguliere groothandel.
De Federation of Pharmaceutical Industries and Association (EFPIA) is in ver gevorderd overleg met de Europese Commissie (EC) over het aanpakken van nep-medicijnen. Het voorstel is om een centraal tracking-systeem in te voeren voor medicijnen. De verpakking krijgt dan een QR-code. In Frankrijk is een QR-code al verplicht voor medicijnverpakkingen. Het Nederlands Verpakkingscentrum (NCV) heeft voorgesteld om er een unieke code van te maken. Deze matrixcode staat voor een uniek cijfer dat gelinkt is aan de historie van het medicijn dat wordt bijgehouden in een centraal databestand. Door de code voor een mobiele telefoon of scanapparaat te houden, wordt er een verbinding gemaakt met het centrale websysteem. De apotheker of de patient controleert vervolgens of het medicijn van de orginele eigenaar afkomstig is. Daarnaast worden op de verpakkingen speciale stickers/sluitingen aangebracht. Deze stickers bestaan uit vezels zodat bij misbruik vezelsporen achterblijven op de verpakking.
De EC wil graag een tracking systeem invoeren dat de gehele route van het medicijn volgt. Dus vanaf het begin van de grondstoffen die gebruikt worden, het verwerken tot een medicijn en uiteindelijk het aanleveren aan de distributeur (apotheek, ziekenhuis, etc). Dit systeem is duur. Daarom pleit de EFPIA voor een alternatief, namelijk een systeem dat het medicijn vanaf de fabrikant tot aan de distributeur bijhoudt. Bovendien wil de vakorganisatie dat deze verpakkingsrichtlijn alleen voor de innovatieve medicijnen (dus medicijnen die nog onder een octrooi vallen) gaat gelden.
EFPIA vreest dat de invoering van een nieuwe verpakkingsrichtlijn leidt tot stagnatie bij de productie van de huidige medicijnen. De dossiers van bestaande medicijnen moeten mogelijk opnieuw gekeurd worden door de gezondheidsautoriteiten omdat de verpakking aangepast worden aan de nieuwe richtlijnen. Dit kan vertraging van de productie tot gevolg hebben. In het ergste geval zou een bestaand product van de markt gehaald worden omdat de klinische studies van toen niet meer voldoen aan de huidige normen. Nieuwe klinische studies zijn dan noodzakelijk. Deze extra studies en het niet op de markt mogen brengen van het medicijn is een grote kostenpost voor de industrie en zal medicijntekorten in de hand werken bij consumenten. Daarom wil de industrie het nieuwe systeem alleen invoeren voor nieuwe innovatieve producten wil en niet voor bestaande producten waar geen octrooi meer voor geldt.
Het zal daarom nog de nodige discussies met zich meebrengen voordat alle neuzen in dezelfde richting staan om een unieke QR code in te voeren. Naast deze voorgenomen plannen is er ook een nieuwe wet opgesteld, de Anti-Counterfeiting Trade Agreement (ACTA). Maar ook de goedkeuring en implementatie van dit instrument om counterfeit te lijf te gaan, verloopt niet zonder slag of stoot. De Europese Commissie heeft onlangs deze wet afgekeurd en het Europees parlement zal dit advies hoogstwaarschijnlijk volgen. De wet is namelijk conflicterend met een aantal Europese regels. Daarnaast is men ook nog bezig aan de harmonisatie van bestaande nationale richtlijnen om deze aan te passen aan de Europese richtlijnen. Het heeft dus heel veel voeten in de aarde om een centraal trackingsysteem in te voeren en de wetten geharmoniseerd dan wel een nieuwe anti-counterfeitwet te krijgen om namaak producten tegen tegaan.
Als alternatief wordt er een ander instrument ingeschakeld namelijk het creëren van een grotere bewustwording onder het publiek. De reguliere bevolking moet inzicht krijgen in de gevaren van het aanschaffen van medicijnen via het internet. Douane beambten, autoriteiten, apothekers en medisch specialisten moeten onderwezen worden over de kwaliteit van het product. In Nederland is, voor zover men weet, de reguliere supply chain nog niet besmet met counterfeit producten.
De QR- code waarborgt de toevoer van geneesmiddelen beter maar daarnaast moet men zich blijven richten tot het reguliere kanaal en niet het internet zodat de counterfeiter zijn nepmedicijn moeilijk zal slijten. Veel maatregelen worden genomen om de volkgezondheid te waarborgen. Alleen de grote vraag is wie de kosten van al deze maatregelen gaat dragen. Het laatste woord is hier nog niet over gezegd.
Corina Post-Wolfert, Abcor Merkenbureau
Beschikbaarheid van geneesmiddelen is belang van het Land
Gerecht in eerste aanleg van Curaçao 4 juli 2012, LJN BX4886 (Vereniging van importeurs van pharmaceutische produkten [VIPP] tegen Het Land Curaçao)
 In geschil is de invoering van maximum prijzen voor geneesmiddelen. Bij Ministeriële Regeling met Algemene Werking van 8 mei 2012, ter uitvoering van artikel 2 van de Prijzenverordening, zijn de per 1 juli 2012 geldende prijzen voor het door importeurs op Curaçao aanbieden of verkopen van geneesmiddelen aan een maximum gebonden. (P.B. Ao 2012 No 28 - Regeling maximumprijzen geneesmiddelen juli 2012).
In geschil is de invoering van maximum prijzen voor geneesmiddelen. Bij Ministeriële Regeling met Algemene Werking van 8 mei 2012, ter uitvoering van artikel 2 van de Prijzenverordening, zijn de per 1 juli 2012 geldende prijzen voor het door importeurs op Curaçao aanbieden of verkopen van geneesmiddelen aan een maximum gebonden. (P.B. Ao 2012 No 28 - Regeling maximumprijzen geneesmiddelen juli 2012).
De VIPP heeft gesteld dat de beschikbaarheid van geneesmiddelen als gevolg van de Regeling niet meer gewaarborgd zal zijn. Het Gerecht oordeelt dat de beschikbaarheid van geneesmiddelen de verantwoordelijkheid is van het Land en niet een belang dat de VIPP volgens haar statuten behartigt. De regering heeft toegezegd de ingangsdatum te willen opschorten tot 1 september. Het Gerecht wijst de gevraagde voorzieningen van de VIPP af.
15. De beschikbaarheid van geneesmiddelen op Curaçao is geen belang dat de VIPP volgens haar statuten behartigt. Het is de verantwoordelijkheid van het Land, dat die verantwoordelijkheid ook zegt te nemen. In het kader van dit kort geding kan daarop dan ook niet verder worden ingegaan. Van de zijde van het Land is ter zitting aangedrongen op goede communicatie met de VIPP. Daaraan zou het hebben ontbroken, nadat de VIPP geen gehoor vond voor haar bezwaren tegen de voorgenomen Regeling. Voor een behoorlijke uitvoering van de Regeling lijkt een goede communicatie tussen de VIPP en de betrokken afdeling van het Land inderdaad van groot belang. Daarbij behoort ook een goede informatievoorziening over en weer, waarmee inmiddels (weer) een begin is gemaakt door toezending van de gegevens die aan bijlage I ten grondslag hebben gelegen. Mogelijke knelpunten zullen immers in een zo vroeg mogelijk stadium moeten worden opgespoord om stagnatie in de geneesmiddelenvoorziening te voorkomen. Artikel 4 van de Regeling biedt ten slotte de mogelijkheid om deze ook vaker dan tweemaal per jaar te wijzigen.
16. De slotsom is dat, met inachtneming van de hiervoor onder 6. weergegeven criteria, voorshands niet kan worden gezegd dat de Regeling onmiskenbaar onverbindend is. De gevraagde voorziening zal dan ook worden geweigerd, met verwijzing van de VIPP als de in het ongelijk gestelde partij in de proceskosten, die aan de zijde van het Land worden begroot op Naf. 1.500,00 wegens salaris van de gemachtigde.
Gevoelens van angst voor bijwerkingen
RCC 22 februari 2012, dossiernr. 2011/01208 (Remark groep Appeleren aan gevoelens van angst voor bijwerkingen geneesmiddelen; misleiding)
 In een serie uitingen over geneesmiddelen is onder andere opgenomen: onder A. “Grijp niet direct naar een geneesmiddel als je ergens last van hebt. Ga niet direct iets slikken bij elk ongemak. Zeker als je probleem redelijk aan de buitenkant van je lichaam zit. Dan is het logischer en efficiënter een middel te gebruiken dat ter plekke zijn werk doet. Dat is minder belastend voor je lichaam. Zo voorkom je nare bijwerkingen. En het levert vaak betere resultaten.” Klager meent dat de tekst appelleert aan angstgevoelens, ex artikel 6 NRC, dat er sprake is van agressieve reclame en dat er op een denigrerend wijze gesproken wordt over geneesmiddelen. Tot slot zijn de I SAY-producten slechts hulpmiddelen, die niet door het CBG worden beoordeeld en de mededeling "vaak betere resultaten" is daarom misleidend ex artikel 8 NRC. In een uitgebreid oordeel worden de klachten voor het overgrote deel gegrond verklaard en een aanbeveling gedaan.
In een serie uitingen over geneesmiddelen is onder andere opgenomen: onder A. “Grijp niet direct naar een geneesmiddel als je ergens last van hebt. Ga niet direct iets slikken bij elk ongemak. Zeker als je probleem redelijk aan de buitenkant van je lichaam zit. Dan is het logischer en efficiënter een middel te gebruiken dat ter plekke zijn werk doet. Dat is minder belastend voor je lichaam. Zo voorkom je nare bijwerkingen. En het levert vaak betere resultaten.” Klager meent dat de tekst appelleert aan angstgevoelens, ex artikel 6 NRC, dat er sprake is van agressieve reclame en dat er op een denigrerend wijze gesproken wordt over geneesmiddelen. Tot slot zijn de I SAY-producten slechts hulpmiddelen, die niet door het CBG worden beoordeeld en de mededeling "vaak betere resultaten" is daarom misleidend ex artikel 8 NRC. In een uitgebreid oordeel worden de klachten voor het overgrote deel gegrond verklaard en een aanbeveling gedaan.
1. Tussen partijen is niet in geschil dat de producten waarop de bestreden uitingen betrekking hebben medische hulpmiddelen zijn in de zin van artikel 1 van de Wet op de medische hulpmiddelen (WMH). In reactie op de klacht is namens adverteerder aangevoerd dat de
i say producten een CE-markering met nummeraanduiding hebben. Het is de Commissie bekend dat een dergelijke CE-markering krachtens artikel 7 van het Besluit medische hulpmiddelen (BMH) wordt afgegeven door een aangewezen instantie die heeft geverifieerd of sprake is van conformiteit van het betreffende product met de essentiële eisen die op het product van toepassing zijn. Nu door Bayer echter niet wordt betwist dat de i say producten een CE-markering hebben, maar - kort samengevat - wordt gesteld dat de uitingen misleidend zijn en appelleren aan gevoelens van angst, kan de verleende CE-markering in de verdere beoordeling buiten beschouwing blijven.
2. Met betrekking tot het beroep van Bayer op artikel 6 NRC overweegt de Commissie het volgende.
Met de tekst “Grijp niet direct naar een geneesmiddel als je ergens last van hebt. Ga niet direct iets slikken bij elk ongemak. Zeker als je probleem redelijk aan de buitenkant van je lichaam zit. Dan is het logischer en efficiënter een middel te gebruiken dat ter plekke zijn werk doet. Dat is minder belastend voor je lichaam. Zo voorkom je nare bijwerkingen. En het levert vaak betere resultaten.” wordt naar het oordeel van de Commissie ingespeeld op gevoelens van angst voor “nare bijwerkingen” van geneesmiddelen. Hiervoor bestaat geen aanleiding. Daarom acht de Commissie de hiervoor aangehaalde tekst op de verpakkingen en de website in strijd met artikel 6 NRC, waarin is bepaald dat reclame zonder te rechtvaardigen redenen niet mag appelleren aan gevoelens van angst.
3. Naar het oordeel van de Commissie is tevens sprake van misleidende reclame. Van de naam “i say bye-bye..” in combinatie met het noemen van een kwaal gaat de suggestie uit dat de kwaal waarvoor het product bestemd is geheel weggaat. In de onder A t/m C aangehaalde uitingen wordt gesteld dat het gebruik van de i say producten logischer en efficiënter is dan het gebruik van geneesmiddelen, de i say producten minder belastend zijn voor het lichaam en de resultaten vaak beter zijn dan bij geneesmiddelen. Voorts wordt geclaimd dat de i say producten geen bijwerkingen kennen en “volkomen veilig” zijn. Nu deze stellingen door Bayer gemotiveerd zijn aangevochten, ligt het op de weg van adverteerder de juistheid ervan aannemelijk te maken. Naar het oordeel van de Commissie is adverteerder daarin niet geslaagd. Ten aanzien van deze kwalificaties is immers geen inhoudelijk verweer gevoerd.
Gelet op het vorenstaande gaan de uitingen gepaard met onjuiste informatie ten aanzien van de voordelen van de i say producten als bedoeld in artikel 8.2. aanhef en onder b NRC. Omdat de Commissie voorts van oordeel is dat de gemiddelde consument door de uitingen ertoe gebracht kan worden een besluit over een transactie te nemen dat hij anders niet had genomen, zijn de uitingen misleidend en daardoor oneerlijk in de zin van artikel 7 NRC.
4. Van agressieve reclame in de zin van artikel 14 lid 1 NRC is sprake als reclame door intimidatie, dwang, inclusief het gebruik van lichamelijk geweld, of ongepaste beïnvloeding de keuzevrijheid of de vrijheid van handelen van de gemiddelde consument met betrekking tot het product aanzienlijk beperkt of kan beperken. Blijkens de toelichting bij artikel 14 NRC wordt onder ongepaste beïnvloeding verstaan het uitbuiten van een machtspositie ten aanzien van de consument om pressie uit te oefenen op een wijze die het vermogen van de consument om een geïnformeerd besluit te nemen, aanzienlijk beperkt. Een dergelijke situatie doet zich naar het oordeel van de Commissie in het onderhavige geval niet voor, zodat de klacht dat sprake is van agressieve en om die reden oneerlijke reclame in de zin van artikel 7 NRC wordt afgewezen.
De e-sigaret is een medisch hulpmiddel en daarmee basta
 Een bijdrage van Hanneke van Lith, Masterstudent IViR.
Een bijdrage van Hanneke van Lith, Masterstudent IViR.
De elektronische sigaret ofwel e-sigaret; een geneesmiddel of slechts een medisch hulpmiddel? Dit is de vraag die in Nederland speelt. De e-sigaret is een vervangend middel voor de reguliere sigaret en kan zonder de schadelijke gevolgen van een normale sigaret door de fervent roker worden gebruikt om zijn/haar behoefte te bevredigen. Het is een veelgebruikt middel om te stoppen met roken en is nicotinehoudend en niet-nicotinehoudend verkrijgbaar. Met name de nicotinehoudende e-sigaretten doen stof opwaaien. In een aantal landen, waaronder België, het Verenigd Koninkrijk en Oostenrijk, wordt de e-sigaret aangeduid als geneesmiddel. In Nederland is de status echter nog onduidelijk. Is het een (hulp)middel om te stoppen met roken of is het een geneesmiddel welke de roker ‘geneest’ van het roken?
Op grond van artikel 1, lid 1, sub b van de Geneesmiddelenwet kan een product worden gekwalificeerd als geneesmiddel door zijn prestatie (aandieningscriterium), door zijn werking (toedieningscriterium) of door beide. In 2007 is de e-sigaret voorlopig aangemerkt als geneesmiddel op basis van het toedieningscriterium. De Minister van Volksgezondheid, Welzijn en Sport, Ab Klink, heeft in 2008 echter bepaald dat er eerst meer afstemming tussen de lidstaten van de EU moet worden bereikt, alvorens een definitief standpunt kan worden ingenomen over de status van de e-sigaret. De aanmerking van de e-sigaret als geneesmiddel in 2007 was slechts een voorlopige beslissing. Sinds 2007 hanteert de Staat een proportioneel handhavingsbeleid met betrekking tot de e-sigaret, wat betekent dat de invoer van en de handel in e-sigaretten zonder handelsvergunning wordt gedoogd, maar dat geen reclame mag worden gemaakt.
Even een sprongetje naar een ander ‘sigarettenvervangend’ middel: de kruidensigaret. Sinds enige tijd zijn er de zogeheten ‘kruidensigaretten’ op de markt, welke bestaan uit een andere stof dan tabak, namelijk (gezonde) kruiden. Deze sigarettenvervanger wordt verkocht bij apotheken en drogisterijen en op de verpakking worden zij aangeduid als ‘medicinale kruidensigaret’. Betekent dit dat deze sigaretten aangeduid kunnen worden als geneesmiddel, vanwege de geclaimde ‘medicinale’ werking? De Hoge Raad heeft op 26 november 2004 een arrest LJN AI0755 gewezen waarbij zij een prejudiciële vraag voorlegt aan het Hof van Justitie van de Europese Gemeenschappen: (verkort) Vallen kruidensigaretten, waarvan is vastgesteld dat deze geen stoffen met een medicinale werking bevatten, maar welke wel met goedkeuring van de KOAG/KAG worden verkocht als ‘Medicinale kruidensigaret’ als hulpmiddel bij het stoppen met roken, onder producten die uitsluitend medische doeleinden dienen? Op 30 maart 2006 antwoordde het Hof van Justitie zaak C-495/04 dat de kruidensigaret niet valt onder producten die uitsluitend een medisch doeleinde dienen. Hierbij stelt zij dat het niet uitmaakt dat de KOAG/KAG de aandiening van de sigaretten heeft goedgekeurd. Deze goedkeuring impliceert namelijk niet dat is getoetst of het betrokken product uitsluitend voor medische doeleinden dient. Het is bekend dat de kruidensigaretten geen stoffen bevatten waarvan de verbranding of inhalatie een wetenschappelijk erkende medicinale, therapeutische of profylactische werking heeft. Het medische doeleinde is dus ver te zoeken. Met het voorgaande wil ik aangeven dat de kruidensigaret niet kan worden aangemerkt als geneesmiddel en past binnen de discussie omtrent de status van ‘sigarettenvervangers’.
Middels een kamerstuk van de huidige Minister van Volksgezondheid, minister Schippers, van 23 december 2011(Kamerstukken II, 2011-2012, 32 793 nr. 10) is geprobeerd een direct ingaand verbod in te stellen op de verkoop van de nicotinehoudende e-sigaretten. De conclusie van Schippers luidt dat de nicotinehoudende e-sigaret slechts verkocht mag worden met een vergunning van het College ter Beoordeling van Geneesmiddelen (CBG). Hiermee wordt in ieder geval de nicotinehoudende e-sigaret door de minister aangemerkt als geneesmiddel op grond van de Geneesmiddelenwet. Zolang er geen handelsvergunning is, is de handel in de e-sigaret verboden en mag er logischerwijs ook geen reclame voor gemaakt worden. Het proportionele handhavingsbeleid van oud-minister Klink wordt hiermee aan de kant geschoven.
United Tobacco Vapor Group, producent en importeur van nicotinehoudende elektronische sigaretten voelt zich tegen de schenen getrapt en is naar de rechter gestapt. De rechtbank ’s-Gravenhage heeft op 13 maart 2012 uitspraak (BV8613) gedaan en heeft geoordeeld dat de beslissing van de minister om de nicotinehoudende e-sigaret definitief aan te merken als geneesmiddel in strijd is met de algemene beginselen van behoorlijk bestuur, met name het motiveringsbeginsel en het rechtszekerheidsbeginsel.
De Staat gaat in hoger beroep, maar dit mocht niet baten (LJN BW8660). Het hof gaat ervan uit dat de consument de e-sigaret gebruikt als genotmiddel, naast dan wel als vervangend middel voor de gewone sigaret (r.o. 8.2). Ook is er, volgens het hof, geen sprake van een door de autoriteiten aangetoond noemenswaardig farmacologisch effect, wat op Europees niveau is vereist om als geneesmiddel te worden aangemerkt (r.o. 8.1). De Staat heeft de e-sigaret nog willen vergelijken met de Nicorette-inhaler, die wel als geneesmiddel is aangemerkt. Dit argument wordt echter meteen in de kiem gesmoord door het hof: niet de inhaler, maar de e-sigaret in staat in dit geding ter discussie. Het hof bekrachtigt in hoofdlijnen het vonnis van de rechtbank. Het hof gebiedt de Staat om toe te staan dat de nicotinehoudende e-sigaretten van Tobacco Vapor Group worden ingevoerd en verhandeld in Nederland, zonder dat de Staat dit verhindert op grond van de Geneesmiddelenwet. Het proportionele handhavingsbeleid wordt dus weer tevoorschijn gehaald.
Om nog even terug te komen op de niet-nicotinehoudende e-sigaret. In een zaak voor de Reclame Code Commissie van 10 juli 2012 wordt door de Voorzitter van de Commissie bevestigd dat reclame voor een niet-nicotinehoudende e-sigaret gewoon is toegestaan: “Anders dan klager stelt, is er geen regelgeving die reclame voor niet nicotinehoudende e-sigaretten verbiedt. Derhalve staat het adverteerder vrij reclame te maken voor dit product.”.. (zie RB 1464).
Al-met-al is er genoeg te doen omtrent de e-sigaret, wel en niet-nicotinehoudend. Vooral omtrent de nicotinehoudende e-sigaret is de status nog onduidelijk. Zelf ben ik van mening dat de nicotinehoudende e-sigaret niet als geneesmiddel, maar als (medisch) hulpmiddel in de zin van artikel 1 lid 1 sub a Wet op de Medische Hulpmiddelen moet worden aangemerkt. Het dient namelijk ter verlichting van de rookverslaving. Ik sluit mij volledig aan bij de overweging van het hof dat de e-sigaret slechts een genot- dan wel vervangingsmiddel is voor de gewone sigaret. Het gebruiken van dit middel ‘geneest’ de roker niet van zijn ongezonde gewoonte, maar helpt hem of haar om ermee te stoppen. De nicotinehoudende e-sigaret is hiervoor uitermate geschikt. Rokers zijn namelijk verslaafd aan nicotine, niet aan tabak. Door het gebruik van een nicotinehoudende e-sigaret kan de behoefte naar een gewone sigaret worden afgebouwd. Rokers die willen stoppen met roken hebben niet voldoende aan een niet-nicotinehoudende sigaret, omdat die hun behoefte naar nicotine niet vervult. De e-sigaret aanmerken als geneesmiddel gaat daarom te ver. Het maken van reclame voor medische hulpmiddelen is niet verboden en dus zie ik geen obstakel voor het gedogen van reclame voor (niet-)nicotinehoudende e-sigaretten. Er is mijns inziens enkel sprake van een therapeutisch doeleinde en een e-sigaret is toch echt wat anders dan een medicijn. Hierbij denk ik aan pillen, inentingen en andere ‘geneesmiddelen’ die een daadwerkelijk medisch doel dienen: het beter maken van mensen.
Inbreuk op Portugese zusteroctrooi in Portugal
Vzr. Rechtbank Utrecht 15 augustus 2012, rolnr. Utrecht KG ZA 12-319, rolnr. 's-Gravenhage KG ZA 12-559 (Boehringer Ingelheim Pharma GmbH & Co.KG tegen Teva Pharma B.V.)
 Uitspraak ingezonden door John Allen, Emma de Groot en Paul van Dongen, NautaDutilh.
Uitspraak ingezonden door John Allen, Emma de Groot en Paul van Dongen, NautaDutilh.
Octrooirecht. Procesrecht. BI is houdster van EP 0 429 987 en het Portugese zusteroctrooi PT 95919 m.b.t. diazepines and their use in the prevention or treatment of HIV infection. Na verder debat heeft de voorzieningenrechter partijen in de gelegenheid gesteld zich bij akte uit te laten over het door het Hof van Justitie van de Europese Unie op 12 juli 2012 gewezen arrest in de zaak Solvay SA v. Honeywell c.s. [IEF 11570].
De Voorzieningenrechter verbiedt Teva Pharma NL om binnen 2 werkdagen na betekening van dit vonnis onrechtmatig jegens BI DE te handelen, meer in het bijzonder door betrokken te zijn bij inbreuk door Teva Pharma PT op PT 919 in Portugal of die inbreuk te faciliteren, waaronder mede wordt verstaan het niet volledig en onvoorwaardelijk intrekken van direct of indirect gegeven toestemming aan Teva Pharma PT om Nevirapina Teva in Portugal in het verkeer te brengen, op straffe van een dwangsom van € 100.000,00 voor iedere dag, of ter keuze van BI DE, € 5.000,00 voor ieder product (waaronder is te verstaan: een patiëntenverpakking van Nevirapina Teva, ongeacht het aantal daarin voorkomende tabletten) waarmee dit verbod zal zijn overtreden;
Verder in citaten:
4.1. Ofschoon deze zaak niet een typische Gat/Luk5-situatie betreft omdat BI DE geen inbreuk op aan haar toekomende intellectuele eigendomsrechten aan haar vorderingen ten grondslag legt maar onrechtmatig handelen van Teva c.s. in Nederland door – kort gezegd – betrokken te zijn bij inbreuk op intellectuele eigendomsrechten in het buitenland, speelt niettemin ook in dit geding de geldigheidsvraag een rol nu de vorderingen van BI DE door Teva c.s. met een geldigheidsverweer worden begroet. Onzeker is of artikel 22 lid 4 EEX-Vo6 hier toepassing vindt. Indien daarvan wordt uitgegaan, komt de voorzieningenrechter in ieder geval op grond van artikel 31 EEX-Vo internationale bevoegdheid toe van de vorderingen strekkende tot het nemen van voorlopige maatregelen kennis te nemen. Anders dan Teva c.s. heeft aangevoerd is er, gezien de vestigingsplaats van Teva c.s., ook sprake van een voldoende reële band met de Nederlandse rechtssfeer. Dat ten aanzien van het gestelde onrechtmatig handelen in Nederland een beoordeling naar vreemd recht noodzakelijk zal zijn ten aanzien van de vraag of er op de (respectieve) intellectuele eigendomsrechten in het buitenland inbreuk wordt gemaakt en in dat kader de geldigheid van die rechten moet worden onderzocht, doet aan de bevoegdheid niet af. Artikel 22 lid 4 EEX-Vo staat daaraan niet in de weg nu uit HvJ EU 12 juli 2012 (zaak C-616/10, Solvay v. Honeywell c.s.) volgt dat artikel 31 EEX-Vo een autonome draagwijdte heeft ten opzichte van eerstgenoemd artikel. Het gevaar voor tegenstrijdige beslissingen ontbreekt nu de voorlopige beslissing in dit geding geenszins vooruit zal lopen op de beslissing ten gronde van de op grond van artikel 22 lid 4 EEX-Vo bevoegde (Portugese) rechter.
4.2. De voorzieningenrechter is op grond van de hoofdregel van artikel 99 lid 1 Rv tevens de relatief bevoegde rechter nu Teva Pharma NL en Teva Europe in dit arrondissement zijn gevestigd. De relatieve bevoegdheid ten aanzien van
Pharmachemie volgt uit artikel 107 Rv. Het verweer van Teva c.s. dat de zaak verkapte octrooiinbreuk betreft en de Utrechtse voorzieningenrechter gezien artikel 80 Rijksoctrooiwet 1995 (hierna: ROW) geen relatieve bevoegheid zou toekomen (volgens Teva c.s. is de Haagse voorzieningenrechter relatief bevoegd), slaagt niet. Aan de vorderingen is geen inbreuk op de aan BI DE als zodanig toekomende octrooirechten ten grondslag gelegd maar onrechtmatig handelen in Nederland. Een dergelijke vordering valt buiten het toepassingsbereik van de uitsluitende bevoegdheidsregeling van artikel 80 lid 2 ROW.
in de procedure tegen Teva Pharma NL:
5.1. verbiedt Teva Pharma NL om binnen 2 werkdagen na betekening van dit vonnis onrechtmatig jegens BI DE te handelen, meer in het bijzonder door betrokken te zijn bij inbreuk door Teva Pharma PT op PT 919 in Portugal of die inbreuk te faciliteren, waaronder mede wordt verstaan het niet volledig en onvoorwaardelijk intrekken van direct of indirect gegeven toestemming aan Teva Pharma PT om Nevirapina Teva in Portugal in het verkeer te brengen, op straffe van een
dwangsom van € 100.000,00 voor iedere dag, of ter keuze van BI DE, € 5.000,00 voor ieder product (waaronder is te verstaan: een patiëntenverpakking van Nevirapina Teva, ongeacht het aantal daarin voorkomende tabletten) waarmee dit
verbod zal zijn overtreden;

















