Rechtbank Den Haag 19 juni 2013, HA ZA 12-1064 (Glenmark Generics B.V. tegen The Wellcome Foundation Ltd)
 Uitspraak ingezonden door Peter Burgers en Rik Lambers, Brinkhof N.V..
Uitspraak ingezonden door Peter Burgers en Rik Lambers, Brinkhof N.V..
Octrooirecht. Hulpverzoek. Bodemprocedure ná IEF 12580. Wellcome is houdster van EP 0 670 719 B1 voor een combinatie van atovaquon met proguanil voor de behandeling van protozoën infecties. Ter gelegenheid van de de Fourth annual malaria meeting heeft Dr. Hutchinson een presentatie gehouden. De High Court of Justice heeft het Britse deel van het octrooi vernietigd wegens gebrek aan inventiviteit. Wellcome verdedigt niet het octrooi, maar beroept zich op een inventief en nawerkbaar hulpverzoek. Het hulpverzoek is, aldus de rechtbank, niet inventief. Als onbestreden staat vast dat de aangevallen volgconclusies eveneens niet inventief zijn, met uitzondering van conclusie 7 van het hulpverzoek. Wellcome wordt veroordeeld in de proceskosten ad €150.000 zoals partijen onderling zijn overeengekomen.
Wellcomes verklaring van afstand van beschermingsomvang is niet ingeschreven in het octrooiregister en de nietigverklaring van het octrooi moet onbestreden worden toegewezen. De presentatie van Hutchinson, die zich het meest nabij de stand van de techniek bevond, waarin een veelbelovende combinatie werd besproken, kon de gemiddelde vakman niet links laten liggen. Dat het onderzoek beperkt was en dat de resultaten onvolledig waren, kan niet leiden tot een ander oordeel. Aangevoerd is dat een pilot of proof of concept study, een eerste stap in het klinisch testen van een geneesmiddel, met een beperkte omvang gebruikelijk is.
2.5. De High Court of Justice, Chancery Division, Patents Court (Arnold J) heeft op 7 februari 2013 uitspraak gedaan in een nietigheidsprocedure tegen het Britse deel van EP 719, aanhangig gemaakt door Glenmark Generics (Europe) Limited en Generics [UK] Limited (handelend onder de naam Mylan). In die procedure werd een oordeel gevraagd over de geldigheid van de conclusies zoals verleend. De Britse bodemrechter oordeelde – kort gezegd – dat de uitvinding van EP 719 voor de hand lag in het licht van onder meer de lezing van Hutchinson en dat het Britse deel van het octrooi derhalve nietig is bij gebrek aan inventiviteit.
3.2. Aan haar vordering legt Glenmark ten grondslag dat het octrooi niet inventief is in het licht van onder meer de lezing van Hutchinson en, voor het geval dat de rechtbank zou oordelen dat het octrooi wel inventief is, dat het octrooi niet nawerkbaar is omdat, kort gezegd, het uitvoeren van klinische studies een onredelijke inspanning van de vakman vergt. Glenmark heeft daarbij uitdrukkelijk verklaard dat zij geen nietigverklaring vordert van conclusie 7.
5.1. Wellcome heeft verklaard dat zij afstand doet van haar recht voor zover de beschermingsomvang verder strekt dan het hulpverzoek, maar gesteld noch gebleken is dat Wellcome een daartoe strekkende akte heeft laten inschrijven in het octrooiregister. Daarom neemt de rechtbank aan dat de bedoelde afstand nog niet is geëffectueerd en dat de nietigverklaring van het octrooi als onbestreden moet worden toegewezen voor zover de beschermingsomvang verder strekt dan het hulpverzoek.
5.7. De rechtbank is van oordeel dat de gemiddelde vakman die op de prioriteitsdatum de therapietrouw en effectiviteit van de behandeling van malaria wilde verbeteren ook zou uitkomen op de geclaimde materie. Wat betreft het verbeteren van de effectiviteit van de behandeling staat daarbij voorop dat de lezing van Hutchinson zelf uitdrukkelijk in de richting wijst van het optimaliseren van de dosering. Hutchinson sluit de lezing namelijk af met de conclusie dat “further dose ranging studies of combination therapy are clearly justified”. Glenmark heeft, onder verwijzing naar de verklaring van haar deskundigen Hill en Molyneux, aangevoerd dat de gemiddelde vakman die, destijds gebruikelijke, doseringsbereikstudies zou hebben uitgevoerd en zou zijn uitgekomen op de geclaimde gewichtsverhouding. Glenmark heeft er daarbij – als zodanig onweersproken – op gewezen dat de geclaimde gewichtsverhouding niet bijzonder is. De standaarddosering van proguanil (200 mg) in combinatie met de dosering van atovaquone waarmee Hutchinson zijn onderzoek is begonnen (500 mg), valt al binnen het geclaimde bereik.
5.12. Wellcome wijst er op dat de toehoorders van Hutchinson (die volgens Wellcome representatief zijn voor de gemiddelde vakman) tijdens zijn lezing sceptisch waren over de resultaten van zijn studies. Die lezing leerde namelijk ook dat atovaquone zelfstandig geen effectief malariabestrijdingsmiddel was omdat het al in een zeer vroeg stadium resistentie verschijnselen liet zien. Voorts was proguanil met name bekend voor profylactisch gebruik. Het mag zo zijn dat in het licht daarvan de in de lezing van Hutchinson geopenbaarde uitkomst onverwacht is (“opmerkelijk” in de woorden van de deskundige van Wellcome) voor de gemiddelde vakman. Dat is echter onvoldoende om aan te nemen dat de gemiddelde vakman de expliciet door Hutchinson aangegeven richting voor verder onderzoek zou negeren. Anders dan in de verleningsprocedure, waarin de examiner heeft aangenomen dat er een “strong prejudice” bestond tegen de combinatie, moet er in de onderhavige procedure namelijk van worden uitgegaan dat de bedoelde verwachtingen van de gemiddelde vakman op de prioriteitsdatum geen vooroordeel opleverden tegen de behandeling van malaria met de combinatie. Wellcome heeft zelf uitdrukkelijk verklaard dat zij geen beroep doet op een vooroordeel, maar alleen wijst op negatieve pointers (pleitnota, paragraaf 16). Zoals Glenmark terecht heeft aangevoerd, daarin gesteund door de verklaring van haar deskundigen Hill en Molyneux, vormt het feit dat de combinatie onverwacht goed lijkt te werken, een reden om juist wel verder onderzoek te doen. Die onverwacht goede werking doet namelijk vermoeden dat het gaat om een combinatie met een potentiërend effect, dat wil zeggen een combinatie waarvan het effect groter is dan de optelsom van de effecten van de individuele geneesmiddelen (zie over dergelijke combinaties, hiervoor r.o. 4.16). Daardoor zou de gemiddelde vakman, ondanks zijn zorgen over de effectiviteit van atovaquone als zelfstandig geneesmiddel, niet automatisch ook de combinatie terzijde schuiven. Het mag zo zijn dat de gemiddelde vakman op basis van Hutchinson nog niet als vaststaand zou aannemen dat die combinatie daadwerkelijk potentiërend is, zoals Wellcome benadrukt, maar dat is ook niet nodig om de vakman aan te sporen om nader onderzoek te doen. Het volstaat dat de onderzoeksresultaten van Hutchinson voor de gemiddelde vakman zodanig overtuigend waren dat een verdere stap in het onderzoek naar de combinatie van atovaquone en proguanil voor de hand lag (zie ook hierna r.o. 5.13). Daarbij is van belang dat ‒ zoals Glenmark onweersproken heeft aangevoerd ‒ malariabestrijding op de prioriteitsdatum zeer problematisch was geworden door wijd verspreide resistentie tegen de bestaande malariabestrijdingsmiddelen, zodat de vakwereld wanhopig op zoek was naar nieuwe effectieve geneesmiddelen. De gemiddelde vakman kon het zich dus niet veroorloven een veelbelovende combinatie links te laten liggen.
5.13. Het betoog van Wellcome dat de gemiddelde vakman zou inzien dat het onderzoek van Hutchinson beperkt was (slechts 24 of 27 patiënten) en dat zijn onderzoeksresultaten onvolledig waren (van 3 of 6 patiënten zijn geen gegevens bekend), kan niet leiden tot een ander oordeel. Glenmark heeft – onder verwijzing naar een verklaring van haar deskundigen Hill en Molyneux en als zodanig onweersproken – aangevoerd dat de gemiddelde vakman het onderzoek van Hutchinson zou zien als een zogeheten pilot of proof of concept study, dat wil zeggen een eerste stap in het klinische testen van een geneesmiddel, en dat bij die studies een relatief beperkte omvang gebruikelijk is. Het doel van een dergelijk onderzoek is dan ook niet om het bewijs te leveren dat een geneesmiddel zodanig veilig en effectief is dat het direct op de markt kan worden gebracht, maar om te kunnen beoordelen of verder onderzoek op zijn plaats is. Een uitkomst waarbij van de 21 patiënten van wie data bekend zijn, er 20 “radically cured” zijn en de recrudescentie bij die ene andere patiënt goed te verklaren is, maakt dat het voor de hand ligt om vervolgonderzoek te doen. De onvolledigheid van de data over de werking van de combinatie zullen mogelijk meebrengen dat de gemiddelde vakman op dit punt wat meer reserves heeft dan Hutchinson zelf tentoonspreidt in zijn presentatie, maar dat neemt niet weg dat het voor de hand lag om de duidelijke aansporing van Hutchinson op te volgen.
Lees de uitspraak HA ZA 12-1064 en schone pdf HA ZA 12-1064.
Uitspraak en samenvatting ingezonden door Jenny Cromsigt, V.O.
 Prejudiciële vragen gesteld door High Court of Justice, Chancery Division, Patents Court (Verenigd Koninkrijk). Zie eerder
Prejudiciële vragen gesteld door High Court of Justice, Chancery Division, Patents Court (Verenigd Koninkrijk). Zie eerder  Octrooirecht. Afwijzing. Astellas is houdster van
Octrooirecht. Afwijzing. Astellas is houdster van 

%20wikimedia.png) De (uitgebreide) nota (betreffende het voorstel tot wijziging van de Rijksoctrooiwet 1995 in verband met de invoering van een beperkte veredelingsvrijstelling), bestaande uit:
De (uitgebreide) nota (betreffende het voorstel tot wijziging van de Rijksoctrooiwet 1995 in verband met de invoering van een beperkte veredelingsvrijstelling), bestaande uit: by Jochen Buehling , for Kluwer Patent Cases The Federal Court of Justice held that under the specific circumstances of the case it was likely that a service manual regarding flow meter technology had been available to third parties. The Court considered as decisive the agreement between the party supplying the manual and the recipient. According to the Court it is relevant whether the parties agreed upon confidentiality either expressly or implicitly or whether it was to be expected under the circumstances that the recipient would keep the information confidential.
by Jochen Buehling , for Kluwer Patent Cases The Federal Court of Justice held that under the specific circumstances of the case it was likely that a service manual regarding flow meter technology had been available to third parties. The Court considered as decisive the agreement between the party supplying the manual and the recipient. According to the Court it is relevant whether the parties agreed upon confidentiality either expressly or implicitly or whether it was to be expected under the circumstances that the recipient would keep the information confidential. by Jochen Buehling , for Kluwer Patent Cases According to the law on employee inventions, the inventor is entitled to information about all income generated by the employer from third parties in exploiting the invention. This information is the basis for claims of the employees against the employer for compensation. The Court confirmed the decisions of the lower courts and held that the income of the employer comprises all financial benefits related to the employees’ invention and its exploitation. This includes not only payments made to the employer but also other benefits such as patent protection.
by Jochen Buehling , for Kluwer Patent Cases According to the law on employee inventions, the inventor is entitled to information about all income generated by the employer from third parties in exploiting the invention. This information is the basis for claims of the employees against the employer for compensation. The Court confirmed the decisions of the lower courts and held that the income of the employer comprises all financial benefits related to the employees’ invention and its exploitation. This includes not only payments made to the employer but also other benefits such as patent protection. by Jochen Buehling , for Kluwer Patent Cases Although the right of the main licensee to use the invention automatically fell back to the licensor upon the licensee’s insolvency, the Court held that the sublicensee enjoys protection of succession and that the sublicense continued to exist despite the termination of the main license.
by Jochen Buehling , for Kluwer Patent Cases Although the right of the main licensee to use the invention automatically fell back to the licensor upon the licensee’s insolvency, the Court held that the sublicensee enjoys protection of succession and that the sublicense continued to exist despite the termination of the main license. 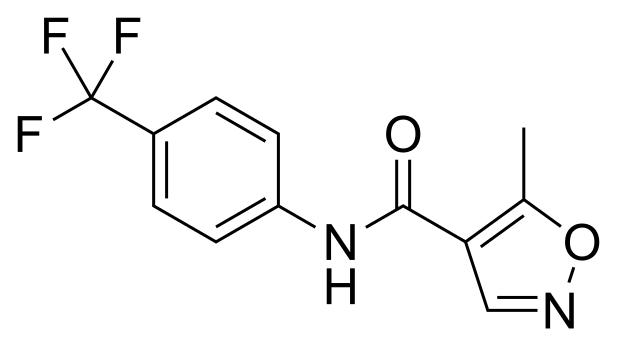 by Thorsten Bausch Hoffmann Eitle and Bernd Kröger. A combination of two pharmaceutical ingredients, i.e. leflunomide and teriflunomide is to be considered obvious if the person skilled in the art uses an obvious process to obtain leflunomide that automatically results in – even with a certain delay – both components due to a chemical reaction.
by Thorsten Bausch Hoffmann Eitle and Bernd Kröger. A combination of two pharmaceutical ingredients, i.e. leflunomide and teriflunomide is to be considered obvious if the person skilled in the art uses an obvious process to obtain leflunomide that automatically results in – even with a certain delay – both components due to a chemical reaction. by Jochen Buehling , for Kluwer Patent Cases The Court held that a lack of impartiality of a court-appointed expert can be assumed if the expert maintains a close economic relationship with one of the parties. This is not necessarily so where the expert was engaged by a third party that maintains a consulting relationship with one of the parties.
by Jochen Buehling , for Kluwer Patent Cases The Court held that a lack of impartiality of a court-appointed expert can be assumed if the expert maintains a close economic relationship with one of the parties. This is not necessarily so where the expert was engaged by a third party that maintains a consulting relationship with one of the parties. by Jochen Buehling , for Kluwer Patent Cases This decision deals with a court order to obtain an expert opinion in a nullity appeal proceeding subject to the new procedural rules that apply to nullity actions filed since October 1, 2009. Due to revised rules in nullity appeal proceedings, as a general rule, the appeal court shall decide on legal questions only, and not questions of fact such as expert opinions. However, the Court held that regarding facts relevant for novelty or inventive step it, the appointment of a court expert to clarify the factual background is still admissible, even if the relevant facts were already a subject in the first instance proceedings.
by Jochen Buehling , for Kluwer Patent Cases This decision deals with a court order to obtain an expert opinion in a nullity appeal proceeding subject to the new procedural rules that apply to nullity actions filed since October 1, 2009. Due to revised rules in nullity appeal proceedings, as a general rule, the appeal court shall decide on legal questions only, and not questions of fact such as expert opinions. However, the Court held that regarding facts relevant for novelty or inventive step it, the appointment of a court expert to clarify the factual background is still admissible, even if the relevant facts were already a subject in the first instance proceedings. by Jochen Buehling , for Kluwer Patent Cases The Appeals Court held that an argument that was not raised in first instance proceedings, shall not be considered a new matter, and consequently be dismissed, if it only further specifies or clarifies the line of argumentation in first instance. On the other hand, f the plaintiff refers to the specifics of a technical teaching disclosed in prior art for the first time at the appeal stage in order to support a nullity attack, it shall be considered a new matter, even if this prior art was already filed in first instance.
by Jochen Buehling , for Kluwer Patent Cases The Appeals Court held that an argument that was not raised in first instance proceedings, shall not be considered a new matter, and consequently be dismissed, if it only further specifies or clarifies the line of argumentation in first instance. On the other hand, f the plaintiff refers to the specifics of a technical teaching disclosed in prior art for the first time at the appeal stage in order to support a nullity attack, it shall be considered a new matter, even if this prior art was already filed in first instance. by Jochen Buehling , for Kluwer Patent Cases Under the doctrine of equivalents, a patent does not convey protection for all options disclosed in the broader patent description if these options are not specifically included in the patent claims.
by Jochen Buehling , for Kluwer Patent Cases Under the doctrine of equivalents, a patent does not convey protection for all options disclosed in the broader patent description if these options are not specifically included in the patent claims. by Lars de Haas , for Kluwer Patent Cases. The Board observed that it could not be understood that the “technical relevance” criterion, proposed by another board in T 1906/11 for judging extension of subject matter, defines a new standard for judging amendments with respect to Article 123(2) in the case of intermediate generalizations. Instead, the Board had to decide whether the technical information inferred by the skilled person was new having regard to the content of the original application as filed.
by Lars de Haas , for Kluwer Patent Cases. The Board observed that it could not be understood that the “technical relevance” criterion, proposed by another board in T 1906/11 for judging extension of subject matter, defines a new standard for judging amendments with respect to Article 123(2) in the case of intermediate generalizations. Instead, the Board had to decide whether the technical information inferred by the skilled person was new having regard to the content of the original application as filed. Met samenvatting van Cees Mulder,
Met samenvatting van Cees Mulder,  Uitspraak ingezonden door Mark van Gardingen, Richard Ebbink, Rik Lambers en Jan Pot,
Uitspraak ingezonden door Mark van Gardingen, Richard Ebbink, Rik Lambers en Jan Pot, 

















